SEARCH
検索詳細菅澤 薫バイオシグナル総合研究センター教授
研究活動情報
■ 論文- Ultraviolet-induced DNA lesions are removed by the nucleotide excision repair (NER) pathway. In global-genome NER (GG-NER), XPC-RAD23B recognizes the lesions and initiates NER. However, cyclobutane pyrimidine dimers (CPDs), which do not significantly destabilize the DNA duplex, are not bound by XPC-RAD23B with high selectivity. Instead, CPD is preferentially sensed by UV-DDB, which is believed to hand over the lesion to XPC-RAD23B via ubiquitination of both proteins. Here, by combining biochemical and single-molecule DNA curtain assays, we investigate the interactions between UV-DDB and XPC-RAD23B on DNA. Surprisingly, we discover that XPC-RAD23B enhances the binding of UV-DDB to DNA. We demonstrate that this enhancement can be attributed to the complex formation of UV-DDB and XPC-RAD23B (UX-complex), which increases the binding affinity of UV-DDB to undamaged DNA. We further show that UV-DDB finds CPDs through one-dimensional (1D) diffusion along DNA. Collectively, the UX-complex enhances UV-DDB loading to DNA to accelerate the search for CPD via 1D diffusion. Moreover, we find that UV-DDB and XPC-RAD23B can bind CPDs as a complex, which facilitates the transfer of CPD. Altogether, our results show that UV-DDB and XPC-RAD23B cooperatively interact for rapid CPD search, providing a new mechanism for lesion search in GG-NER.2025年06月, Nucleic acids research, 53(11) (11), 英語, 国際誌研究論文(学術雑誌)
- The production of reactive oxygen species in response to RNA virus infection results in the oxidation of viral genomic RNA within infected cells. These oxidative RNA lesions undergo replication catalyzed by the viral replisome. G to U transversion mutations are frequently observed in the SARS-CoV-2 genome and may be linked to the replication process catalyzed by RNA-dependent RNA polymerase (RdRp) past the oxidative RNA lesion 7,8-dihydro-8-oxo-riboguanosine (8-oxo-rG). To better understand the mechanism of viral RNA mutagenesis, it is crucial to elucidate the role of RdRp in replicating across oxidative lesions. In this study, we investigated the RNA synthesis catalyzed by the reconstituted SARS-CoV-2 RdRp past a single 8-oxo-rG. The RdRp-mediated primer extension was significantly inhibited by 8-oxo-rG on the template RNA. A steady-state multiple-turnover reaction demonstrated that the turnover rate of RdRp was significantly slow when replication was blocked by 8-oxo-rG, reflecting low bypass efficiency even with prolonged reaction time. Once RdRp was able to bypass 8-oxo-rG, it preferentially incorporated rCMP, with a lesser amount of rAMP opposite 8-oxo-rG. In contrast, RdRp demonstrated greater activity in extending from the mutagenic rA:8-oxo-rG terminus compared to the lower efficiency of extension from the rC:8-oxo-rG pair. Based on steady-state kinetic analyses for the incorporation of rNMPs opposite 8-oxo-rG and chain extension from rC:8-oxo-rG or rA:8-oxo-rG, the relative bypass frequency for rA:8-oxo-rG was found to be seven-fold higher than that for rC:8-oxo-rG. Therefore, the properties of RdRp indicated in this study may contribute to the mechanism of mutagenesis of the SARS-CoV-2 genome.2025年04月, The Journal of biological chemistry, 108512 - 108512, 英語, 国際誌研究論文(学術雑誌)
- Summary Fanconi anemia (FA) is a rare genetic disease caused by the loss of function of one of the 22 associated genes and is characterized by bone marrow failure, cancer predisposition, and developmental defects. The proteins encoded by these genes (FA proteins) mainly function in DNA damage response and repair. Although FA deficiency has multiple effects on the regulation of lipid metabolism, the molecular function of FA proteins in the context of FA pathology remains unclear. In the present study, we demonstrated that FANCD2, a key component of FA proteins, interacts with lipid metabolism-related factors and that FANCD2 deficiency downregulates the cellular levels of fatty acids. Moreover, a portion of FANCD2 is localized to nuclear lipid droplets in response to oleic acid treatment. These subcellular dynamics are independent of FANCD2 monoubiquitination, which is essential for the DNA damage response. Collectively, these findings demonstrate that FANCD2 responds to not only DNA damage but also oleic acid exposure, providing insights into the pathogenesis of lipid dysregulation in FA.Cold Spring Harbor Laboratory, 2025年02月
- 2025年02月, 生化学, 97(1) (1), 61 - 65, 日本語ヌクレオチド除去修復のDNA損傷認識を制御するクロマチンダイナミクス[査読有り]研究論文(学術雑誌)
- How the fate (folding versus degradation) of glycoproteins is determined in the endoplasmic reticulum (ER) is an intriguing question. Monoglucosylated glycoproteins are recognized by lectin chaperones to facilitate their folding, whereas glycoproteins exposing well-trimmed mannoses are subjected to glycoprotein ER-associated degradation (gpERAD); we have elucidated how mannoses are sequentially trimmed by EDEM family members (George et al., 2020; 2021 eLife). Although reglucosylation by UGGT was previously reported to have no effect on substrate degradation, here we directly tested this notion using cells with genetically disrupted UGGT1/2. Strikingly, the results showed that UGGT1 delayed the degradation of misfolded substrates and unstable glycoproteins including ATF6α. An experiment with a point mutant of UGGT1 indicated that the glucosylation activity of UGGT1 was required for the inhibition of early glycoprotein degradation. These and overexpression-based competition experiments suggested that the fate of glycoproteins is determined by a tug-of-war between structure formation by UGGT1 and degradation by EDEMs. We further demonstrated the physiological importance of UGGT1, since ATF6α cannot function properly without UGGT1. Thus, our work strongly suggests that UGGT1 is a central factor in ER protein quality control via the regulation of both glycoprotein folding and degradation.2024年12月, eLife, 12, 英語, 国際誌研究論文(学術雑誌)
- It remains uncertain how global genome nucleotide excision repair (GG-NER) efficiently removes various helix distorting DNA lesions in the cell nucleus. Here, we present a protocol to assess the contribution of factors of interest to GG-NER using two types of fluorescence-microscopy-based techniques. First, we describe steps for analyzing the localization of the factors upon local ultraviolet (UV) irradiation. We then detail the second technique, which quantifies the removal of UV-induced photolesions combined with lesion-specific antibodies and program-based image analysis. For complete details on the use and execution of this protocol, please refer to Kusakabe et al.1.2023年06月, STAR protocols, 4(3) (3), 102378 - 102378, 英語, 国際誌研究論文(学術雑誌)
- Elsevier BV, 2023年06月, Journal of Biological Chemistry, 105002 - 105002研究論文(学術雑誌)
- Springer Science and Business Media LLC, 2023年04月, Nature, 617(7959) (7959), 170 - 175研究論文(学術雑誌)
- 2022年11月, The Journal of Dermatology, 50(3) (3), 407 - 408, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- The XPC protein complex plays a central role in DNA lesion recognition for global genome nucleotide excision repair (GG-NER). Lesion recognition can be accomplished in either a UV-DDB-dependent or -independent manner; however, it is unclear how these sub-pathways are regulated in chromatin. Here, we show that histone deacetylases 1 and 2 facilitate UV-DDB-independent recruitment of XPC to DNA damage by inducing histone deacetylation. XPC localizes to hypoacetylated chromatin domains in a DNA damage-independent manner, mediated by its structurally disordered middle (M) region. The M region interacts directly with the N-terminal tail of histone H3, an interaction compromised by H3 acetylation. Although the M region is dispensable for in vitro NER, it promotes DNA damage removal by GG-NER in vivo, particularly in the absence of UV-DDB. We propose that histone deacetylation around DNA damage facilitates the recruitment of XPC through the M region, contributing to efficient lesion recognition and initiation of GG-NER.Elsevier BV, 2022年04月, iScience, 25(4) (4), 104040 - 104040, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- SIRT2 and SIRT3 protein deacetylases maintain genome integrity and stability. However, their mechanisms for maintaining the genome remain unclear. To examine the roles of SIRT2 and SIRT3 in DSB repair, I-SceI-based GFP reporter assays for HR, single-strand annealing (SSA) and nonhomologous end joining (NHEJ) repair were performed under SIRT2- or SIRT3-depleted conditions. SIRT2 or SIRT3 depletion inhibited HR repair equally to RAD52 depletion, but did not affect SSA and NHEJ repairs. SIRT2 or SIRT3 depletion disturbed the recruitment of RAD51 to DSB sites, an essential step for RAD51-dependent HR repair, but not directly through RAD52 deacetylation. SIRT2 or SIRT3 depletion decreased the colocalization of γH2AX foci with RPA1, and thus, they might be involved in initiating DSB end resection for the recruitment of RAD51 to DSB sites at an early step in HR repair. These results show the novel underlying mechanism of the SIRT2 and SIRT3 functions in HR for genome stability.2021年02月, Genes to cells : devoted to molecular & cellular mechanisms, 26(5) (5), 328 - 335, 英語, 国際誌研究論文(学術雑誌)
- Nucleotide excision repair (NER) is a pathway involved in the repair of a variety of potentially mutagenic lesions that distort the DNA double helix. The ubiquitin E3-ligase complex UV-DDB is required for the recognition and repair of UV-induced cyclobutane pyrimidine dimers (CPDs) lesions through NER. DDB2 directly binds CPDs and subsequently undergoes ubiquitination and proteasomal degradation. DDB2 must remain on damaged chromatin, however, for sufficient time to recruit and hand-off lesions to XPC, a factor essential in the assembly of downstream repair components. Here we show that the tumor suppressor USP44 directly deubiquitinates DDB2 to prevent its premature degradation and is selectively required for CPD repair. Cells lacking USP44 have impaired DDB2 accumulation on DNA lesions with subsequent defects in XPC retention. The physiological importance of this mechanism is evident in that mice lacking Usp44 are prone to tumors induced by NER lesions introduced by DMBA or UV light. These data reveal the requirement for highly regulated ubiquitin addition and removal in the recognition and repair of helix-distorting DNA damage and identify another mechanism by which USP44 protects genomic integrity and prevents tumors.2021年, Frontiers in cell and developmental biology, 9, 663411 - 663411, 英語, 国際誌研究論文(学術雑誌)
- Squamous cell carcinoma (SCC) occurs frequently in the human Xeroderma Pigmentosum (XP) syndrome and is characterized by deficient UV-damage repair. SCC is the most common equine ocular cancer and the only associated genetic risk factor is a UV-damage repair protein. Specifically, a missense mutation in horse DDB2 (T338M) was strongly associated with both limbal SCC and third eyelid SCC in three breeds of horses (Halflinger, Belgian, and Rocky Mountain Horses) and was hypothesized to impair binding to UV-damaged DNA. Here, we investigate DDB2-T338M mutant's capacity to recognize UV lesions in vitro and in vivo, together with human XP mutants DDB2-R273H and -K244E. We show that the recombinant DDB2-T338M assembles with DDB1, but fails to show any detectable binding to DNA substrates with or without UV lesions, due to a potential structural disruption of the rigid DNA recognition β-loop. Consistently, we demonstrate that the cellular DDB2-T338M is defective in its recruitment to focally radiated DNA damages, and in its access to chromatin. Thus, we provide direct functional evidence indicating the DDB2-T338M recapitulates molecular defects of human XP mutants, and is the causal loss-of-function allele that gives rise to equine ocular SCCs. Our findings shed new light on the mechanism of DNA recognition by UV-DDB and on the initiation of ocular malignancy.2021年01月, DNA repair, 97, 103022 - 103022, 英語, 国際誌研究論文(学術雑誌)
- The ubiquitin-proteasome system (UPS) plays crucial roles in regulation of various biological processes, including DNA repair. In mammalian global genome nucleotide excision repair (GG-NER), activation of the DDB2-associated ubiquitin ligase upon UV-induced DNA damage is necessary for efficient recognition of lesions. To date, however, the precise roles of UPS in GG-NER remain incompletely understood. Here, we show that the proteasome subunit PSMD14 and the UPS shuttle factor RAD23B can be recruited to sites with UV-induced photolesions even in the absence of XPC, suggesting that proteolysis occurs at DNA damage sites. Unexpectedly, sustained inhibition of proteasome activity results in aggregation of PSMD14 (presumably with other proteasome components) at the periphery of nucleoli, by which DDB2 is immobilized and sequestered from its lesion recognition functions. Although depletion of PSMD14 alleviates such DDB2 immobilization induced by proteasome inhibitors, recruitment of DDB2 to DNA damage sites is then severely compromised in the absence of PSMD14. Because all of these proteasome dysfunctions selectively impair removal of cyclobutane pyrimidine dimers, but not (6-4) photoproducts, our results indicate that the functional integrity of the proteasome is essential for the DDB2-mediated lesion recognition sub-pathway, but not for GG-NER initiated through direct lesion recognition by XPC.2020年11月, Scientific Reports, 10(1) (1), 19704 - 19704, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- Ribonucleoside triphosphates are often incorporated into genomic DNA during DNA replication. The accumulation of unrepaired ribonucleotides is associated with genomic instability, which is mediated by DNA topoisomerase 1 (Top1) processing of embedded ribonucleotides. The cleavage initiated by Top1 at the site of a ribonucleotide leads to the formation of a Top1-DNA cleavage complex (Top1cc), occasionally resulting in a DNA double-strand break (DSB). In humans, tyrosyl-DNA phosphodiesterases (TDPs) are essential repair enzymes that resolve the trapped Top1cc followed by downstream repair factors. However, there is limited cellular evidence of the involvement of TDPs in the processing of incorporated ribonucleotides in mammals. We assessed the role of TDPs in mutagenesis induced by a single ribonucleotide embedded into DNA. A supF shuttle vector site-specifically containing a single riboguanosine (rG) was introduced into the human lymphoblastoid TK6 cell line and its TDP1-, TDP2-, and TDP1/TDP2-deficient derivatives. TDP1 and TDP2 insufficiency remarkably decreased the mutant frequency caused by an embedded rG. The ratio of large deletion mutations induced by rG was also substantially lower in TDP1/TDP2-deficient cells than wild-type cells. Furthermore, the disruption of TDPs reduced the length of rG-mediated large deletion mutations. The recovery ratio of the propagated plasmid was also increased in TDP1/TDP2-deficient cells after the transfection of the shuttle vector containing rG. The results suggest that TDPs-mediated ribonucleotide processing cascade leads to unfavorable consequences, whereas in the absence of these repair factors, a more error-free processing pathway might function to suppress the ribonucleotide-induced mutagenesis. Furthermore, base substitution mutations at sites outside the position of rG were detected in the supF gene via a TDPs-independent mechanism. Overall, we provide new insights into the mechanism of mutagenesis induced by an embedded ribonucleotide in mammalian cells, which may lead to the fatal phenotype in the ribonucleotide excision repair deficiency.2020年, PloS one, 15(12) (12), e0244790, 英語, 国際誌研究論文(学術雑誌)
- Centrin 2 is a small conserved calcium-binding protein that localizes to the centriolar distal lumen in human cells. It is required for efficient primary ciliogenesis and nucleotide excision repair (NER). Centrin 2 forms part of the xeroderma pigmentosum group C protein complex. To explore how centrin 2 contributes to these distinct processes, we mutated the four calcium-binding EF-hand domains of human centrin 2. Centrin 2 in which all four EF-hands had been mutated to ablate calcium binding (4DA mutant) was capable of supporting in vitro NER and was as effective as the wild-type protein in rescuing the UV sensitivity of centrin 2-null cells. However, we found that mutation of any of the EF-hand domains impaired primary ciliogenesis in human TERT-RPE1 cells to the same extent as deletion of centrin 2. Phenotypic analysis of the 4DA mutant revealed defects in centrosome localization, centriole satellite assembly, ciliary assembly and function and in interactions with POC5 and SFI1. These observations indicate that centrin 2 requires calcium-binding capacity for its primary ciliogenesis functions, but not for NER, and suggest that these functions require centrin 2 to be capable of forming complexes with partner proteins.This article has an associated First Person interview with the first author of the paper.2019年10月, Journal of cell science, 132(19) (19), 英語, 国際誌[査読有り]
- DNA polymerases often incorporate non-canonical nucleotide, i.e., ribonucleoside triphosphates into the genomic DNA. Aberrant accumulation of ribonucleotides in the genome causes various cellular abnormalities. Here, we show the possible role of human nucleotide excision repair (NER) and DNA polymerase η (Pol η) in processing of a single ribonucleotide embedded into DNA. We found that the reconstituted NER system can excise the oxidized ribonucleotide on the plasmid DNA. Taken together with the evidence that Pol η accurately bypasses a ribonucleotide, i.e., riboguanosine (rG) or its oxidized derivative (8-oxo-rG) in vitro, we further assessed the mutagenic potential of the embedded ribonucleotide in human cells lacking NER or Pol η. A single rG on the supF reporter gene predominantly induced large deletion mutations. An embedded 8-oxo-rG caused base substitution mutations at the 3'-neighboring base rather than large deletions in wild-type cells. The disruption of XPA, an essential factor for NER, or Pol η leads to the increased mutant frequency of 8-oxo-rG. Furthermore, the frequency of 8-oxo-rG-mediated large deletions was increased by the loss of Pol η, but not XPA. Collectively, our results suggest that base oxidation of the embedded ribonucleotide enables processing of the ribonucleotide via alternative DNA repair and damage tolerance pathways.2019年09月, Scientific Reports, 9(1) (1), 13910 - 13910, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2019年07月, Nature, 571(7764) (7764), E6, 英語Publisher Correction: DNA damage detection in nucleosomes involves DNA register shifting.[査読有り]研究論文(学術雑誌)
- 2019年07月, Nature, 571(7763) (7763), 79 - 84, 英語DNA damage detection in nucleosomes involves DNA register shifting.[査読有り]研究論文(学術雑誌)
- Nucleotide excision repair (NER) is a versatile DNA repair pathway that eliminates various helix-distorting base lesions such as ultraviolet (UV)-induced photolesions. Several recessive human disorders, such as xeroderma pigmentosum (XP), are caused by hereditary defects in NER, implying that the pathway plays critical roles in suppressing diverse pathogenic processes, including carcinogenesis. In general, discrimination of lesion sites from intact DNA, which is present in vast excess, is a key determinant of the overall efficiency of DNA repair. In mammalian cells, global genomic NER lesion recognition is initiated by the XPC protein complex, which achieves broad DNA-binding specificity by sensing destabilized base pairs rather than lesions per se. To avert unnecessary incisions at lesion-free sites, and thereby ensure the fidelity of the repair system, transcription factor IIH and the XPA protein then verify the presence of relevant lesions at suspicious sites bound by XPC. In the case of UV-induced photolesions, a specialized lesion sensor called UV-damaged DNA-binding protein (UV-DDB) contributes to efficient lesion recognition and the recruitment of XPC to lesion sites. The ubiquitin-proteasome system plays a crucial role in the handoff of lesions from UV-DDB to XPC and the subsequent NER process. In addition, recognition of lesions targeted by global genomic NER is intricately regulated by higher-order chromatin structures, which play distinct roles depending on the type of lesion.2019年, The Enzymes, 45, 99 - 138, 英語, 国際誌[査読有り]
- Nucleotide excision repair (NER) is a versatile DNA repair pathway, which can remove an extremely broad range of base lesions from the genome. In mammalian global genomic NER, the XPC protein complex initiates the repair reaction by recognizing sites of DNA damage, and this depends on detection of disrupted/destabilized base pairs within the DNA duplex. A model has been proposed that XPC first interacts with unpaired bases and then the XPD ATPase/helicase in concert with XPA verifies the presence of a relevant lesion by scanning a DNA strand in 5'-3' direction. Such multi-step strategy for damage recognition would contribute to achieve both versatility and accuracy of the NER system at substantially high levels. In addition, recognition of ultraviolet light (UV)-induced DNA photolesions is facilitated by the UV-damaged DNA-binding protein complex (UV-DDB), which not only promotes recruitment of XPC to the damage sites, but also may contribute to remodeling of chromatin structures such that the DNA lesions gain access to XPC and the following repair proteins. Even in the absence of UV-DDB, however, certain types of histone modifications and/or chromatin remodeling could occur, which eventually enable XPC to find sites with DNA lesions. Exploration of novel factors involved in regulation of the DNA damage recognition process is now ongoing.BMC, 2019年, Genes and environment : the official journal of the Japanese Environmental Mutagen Society, 41, 2 - 2, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- Fanconi anemia (FA) is a rare genetic disease characterized by the deficiency of the cellular response and repair pathway for DNA interstrand crosslink (ICL) damage. Although recent studies have revealed the detailed molecular functions of FA proteins encoded by 22 genes, the mechanism of occurrence of endogenous ICLs in the human body remains poorly understood. In this short review, we summarize the potential endogenous sources of ICLs counteracted by FA proteins, and provide perspectives on the unanswered questions regarding FA.2019年, Genes and environment : the official journal of the Japanese Environmental Mutagen Society, 41, 6 - 6, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- Blackwell Publishing Ltd, 2018年06月, British Journal of Dermatology, 178(6) (6), 1451 - 1452, 英語研究論文(学術雑誌)
- The p300 and CBP histone acetyltransferases are recruited to DNA double-strand break (DSB) sites where they induce histone acetylation, thereby influencing the chromatin structure and DNA repair process. Whether p300/CBP at DSB sites also acetylate non-histone proteins, and how their acetylation affects DSB repair, remain unknown. Here we show that p300/CBP acetylate RAD52, a human homologous recombination (HR) DNA repair protein, at DSB sites. Using in vitro acetylated RAD52, we identified 13 potential acetylation sites in RAD52 by a mass spectrometry analysis. An immunofluorescence microscopy analysis revealed that RAD52 acetylation at DSBs sites is counteracted by SIRT2- and SIRT3-mediated deacetylation, and that non-acetylated RAD52 initially accumulates at DSB sites, but dissociates prematurely from them. In the absence of RAD52 acetylation, RAD51, which plays a central role in HR, also dissociates prematurely from DSB sites, and hence HR is impaired. Furthermore, inhibition of ataxia telangiectasia mutated (ATM) protein by siRNA or inhibitor treatment demonstrated that the acetylation of RAD52 at DSB sites is dependent on the ATM protein kinase activity, through the formation of RAD52, p300/CBP, SIRT2, and SIRT3 foci at DSB sites. Our findings clarify the importance of RAD52 acetylation in HR and its underlying mechanism.2018年03月, PLoS genetics, 14(3) (3), e1007277, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2018年02月, Genes Cells, 23(3) (3), 200 - 213, 英語Mutations at multiple CDK phosphorylation consensus sites on Cdt2 increase the affinity of CRL4Cdt2 for PCNA and its ubiquitination activity in S phase.[査読有り]研究論文(学術雑誌)
- 2017年04月, GENES TO CELLS, 22(4) (4), 392 - 405, 英語[査読有り]研究論文(学術雑誌)
- 2017年04月, CELL REPORTS, 19(1) (1), 162 - 174, 英語[査読有り]研究論文(学術雑誌)
- 2017年03月, GENES TO CELLS, 22(3) (3), 310 - 327, 英語[査読有り]研究論文(学術雑誌)
- 2017年, CELL CYCLE, 16(7) (7), 673 - 684, 英語[査読有り]研究論文(学術雑誌)
- 2017年01月, SCIENTIFIC REPORTS, 7(7) (7), 41783, 英語[査読有り]研究論文(学術雑誌)
- BACKGROUND: Most patients with xeroderma pigmentosum complementation group D (XP-D) from Western countries suffer from neurological symptoms, whereas Japanese patients display only skin manifestations without neurological symptoms. We have previously suggested that these differences in clinical manifestations in XP-D patients are attributed partly to a predominant mutation in ERCC2, and the allele frequency of S541R is highest in Japan. METHODS: We diagnosed a child with mild case of XP-D by the evaluation of DNA repair activity and whole-genome sequencing, and followed her ten years. RESULTS: Skin cancer, mental retardation, and neurological symptoms were not observed. Her minimal erythema dose was 41 mJ/cm(2) , which was slightly lower than that of healthy Japanese volunteers. The patient's cells showed sixfold hypersensitivity to UV in comparison with normal cells. Post-UV unscheduled DNA synthesis was 20.4%, and post-UV recovery of RNA synthesis was 58% of non-irradiated samples, which was lower than that of normal fibroblasts. Genome sequence analysis indicated that the patient harbored a compound heterozygous mutation of c.1621A>C and c.591_594del, resulting in p.S541R and p.Y197* in ERCC2: then, patient was diagnosed with XP-D. Y197* has not been described before. CONCLUSION: Her mild skin manifestations might be attributed to the mutational site on her genome and daily strict sun protection. c.1621A>C might be a founder mutation of ERCC2 among Japanese XP-D patients, as it was identified most frequently in Japanese XP-D patients and it has not been found elsewhere outside Japan.2016年07月, Photodermatology, photoimmunology & photomedicine, 32(4) (4), 174 - 80, 英語, 国際誌[査読有り][招待有り]研究論文(学術雑誌)
- 2016年03月, NATURE, 531(7596) (7596), 598 - +, 英語[査読有り]研究論文(学術雑誌)
- 2016年03月, NATURE, 531(7596) (7596), 598 - +, 英語研究論文(学術雑誌)
- 2016年02月, BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS, 471(1) (1), 117 - 122, 英語[査読有り]研究論文(学術雑誌)
- 2016年02月, Journal of pharmaceutical negative results, 7, 42 - 45, 英語2,2,4-Triamino-5(2H)-oxazolone is a weak substrate for nucleotide excision repair[査読有り]研究論文(学術雑誌)
- Medknow Publications, 2016年01月, Journal of Pharmaceutical Negative Results, 7(1) (1), 42 - 45, 英語[査読有り]研究論文(学術雑誌)
- UV-DDB, an initiation factor for the nucleotide excision repair pathway, recognizes 6-4PP lesions through a base flipping mechanism. As genomic DNA is almost entirely accommodated within nucleosomes, the flipping of the 6-4PP bases is supposed to be extremely difficult if the lesion occurs in a nucleosome, especially on the strand directly contacting the histone surface. Here we report that UV-DDB binds efficiently to nucleosomal 6-4PPs that are rotationally positioned on the solvent accessible or occluded surface. We determined the crystal structures of nucleosomes containing 6-4PPs in these rotational positions, and found that the 6-4PP DNA regions were flexibly disordered, especially in the strand exposed to the solvent. This characteristic of 6-4PP may facilitate UV-DDB binding to the damaged nucleosome. We present the first atomic-resolution pictures of the detrimental DNA cross-links of neighboring pyrimidine bases within the nucleosome, and provide the mechanistic framework for lesion recognition by UV-DDB in chromatin.2015年11月, Scientific reports, 5, 16330 - 16330, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2015年10月, STRUCTURE, 23(10) (10), 1827 - 1837, 英語[査読有り]研究論文(学術雑誌)
- 2015年09月, MOLECULAR CELL, 59(6) (6), 1025 - 1034, 英語[査読有り]研究論文(学術雑誌)
- The xeroderma pigmentosum group C (XPC) protein complex is a key factor that detects DNA damage and initiates nucleotide excision repair (NER) in mammalian cells. Although biochemical and structural studies have elucidated the interaction of XPC with damaged DNA, the mechanism of its regulation in vivo remains to be understood in more details. Here, we show that the XPC protein undergoes modification by small ubiquitin-related modifier (SUMO) proteins and the lack of this modification compromises the repair of UV-induced DNA photolesions. In the absence of SUMOylation, XPC is normally recruited to the sites with photolesions, but then immobilized profoundly by the UV-damaged DNA-binding protein (UV-DDB) complex. Since the absence of UV-DDB alleviates the NER defect caused by impaired SUMOylation of XPC, we propose that this modification is critical for functional interactions of XPC with UV-DDB, which facilitate the efficient damage handover between the two damage recognition factors and subsequent initiation of NER.2015年06月, Scientific reports, 5(5) (5), 10984 - 10984, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- The xeroderma pigmentosum group C (XPC) protein complex is a key factor that detects DNA damage and initiates nucleotide excision repair (NER) in mammalian cells. Although biochemical and structural studies have elucidated the interaction of XPC with damaged DNA, the mechanism of its regulation in vivo remains to be understood in more details. Here, we show that the XPC protein undergoes modification by small ubiquitin-related modifier (SUMO) proteins and the lack of this modification compromises the repair of UV-induced DNA photolesions. In the absence of SUMOylation, XPC is normally recruited to the sites with photolesions, but then immobilized profoundly by the UV-damaged DNA-binding protein (UV-DDB) complex. Since the absence of UV-DDB alleviates the NER defect caused by impaired SUMOylation of XPC, we propose that this modification is critical for functional interactions of XPC with UV-DDB, which facilitate the efficient damage handover between the two damage recognition factors and subsequent initiation of NER.2015年06月, Scientific reports, 5, 10984 - 10984, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2015年06月, Structure, 5, 10984, 英語[査読有り]研究論文(学術雑誌)
- 2015年04月, DNA REPAIR, 28, 139 - 140, 英語Structures of the nucleosomes containing UV-damaged DNA bases and the damaged base recognition mechanism by DNA repair proteins
- 2015年03月, GENES TO CELLS, 20(3) (3), 191 - 202, 英語[査読有り]研究論文(学術雑誌)
- In mammalian nucleotide excision repair, the DDB1-DDB2 complex recognizes UV-induced DNA photolesions and facilitates recruitment of the XPC complex. Upon binding to damaged DNA, the Cullin 4 ubiquitin ligase associated with DDB1-DDB2 is activated and ubiquitinates DDB2 and XPC. The structurally disordered N-terminal tail of DDB2 contains seven lysines identified as major sites for ubiquitination that target the protein for proteasomal degradation; however, the precise biological functions of these modifications remained unknown. By exogenous expression of mutant DDB2 proteins in normal human fibroblasts, here we show that the N-terminal tail of DDB2 is involved in regulation of cellular responses to UV. By striking contrast with behaviors of exogenous DDB2, the endogenous DDB2 protein was stabilized even after UV irradiation as a function of the XPC expression level. Furthermore, XPC competitively suppressed ubiquitination of DDB2 in vitro, and this effect was significantly promoted by centrin-2, which augments the DNA damage-recognition activity of XPC. Based on these findings, we propose that in cells exposed to UV, DDB2 is protected by XPC from ubiquitination and degradation in a stochastic manner; thus XPC allows DDB2 to initiate multiple rounds of repair events, thereby contributing to the persistence of cellular DNA repair capacity.2015年02月, Nucleic acids research, 43(3) (3), 1700 - 13, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- For organisms, a fundamental problem is how the huge genome can be searched appropriately for DNA damage in order to prevent genome instability and/or cell death. In mammalian nucleotide excision repair (NER), this process involves multiple protein factors containing the xeroderma pigmentosum gene products (UV-DDB, XPC, TFIIH), which sense different aspects of DNA structural abnormalities, respectively. Coordinated stepwise actions of these factors contribute to simultaneous achievement of versatility, efficiency and accuracy of the DNA quality control for NER.The Biophysical Society of Japan General Incorporated Association, 2015年, 生物物理, 55(3) (3), 137 - 141, 日本語
- Elsevier, 2014年10月, FEBS Letters, 588(20) (20), 3778 - 3785, 英語[査読有り]研究論文(学術雑誌)
- 2014年10月, FEBS LETTERS, 588(20) (20), 3778 - 3785, 英語[査読有り]研究論文(学術雑誌)
- 2014年07月, SCIENTIFIC REPORTS, 4, 5578, 英語[査読有り]研究論文(学術雑誌)
- 2014年07月, SCIENTIFIC REPORTS, 4, 5578, 英語[査読有り]研究論文(学術雑誌)
- 2014年05月, BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS, 447(3) (3), 419 - 424, 英語[査読有り]研究論文(学術雑誌)
- 2014年05月, CELL REPORTS, 7(4) (4), 1039 - 1047, 英語[査読有り]研究論文(学術雑誌)
- 2014年05月, BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS, 447(3) (3), 419 - 424, 英語[査読有り]研究論文(学術雑誌)
- 2014年05月, CELL REPORTS, 7(4) (4), 1039 - 1047, 英語[査読有り]研究論文(学術雑誌)
- 一般社団法人 日本生物物理学会, 2014年, 生物物理, 54(1) (1), S214, 英語
- 2014年01月, DEVELOPMENT, 141(2) (2), 269 - 280, 英語[査読有り]研究論文(学術雑誌)
- 2014年, Genes Cells., 20(3) (3), 191 - 202, 英語Human mediator MED17 subunit plays essential roles in gene regulation by associating with the transcription and DNA repair machineries.[査読有り]研究論文(学術雑誌)
- 2014年01月, DEVELOPMENT, 141(2) (2), 269 - 280, 英語[査読有り]研究論文(学術雑誌)
- 2013年12月, Journal of Molecular Recognition, 26(12) (12), 653 - 661, 英語[査読有り]研究論文(学術雑誌)
- Centrin-2 is an evolutionarily conserved, calmodulin-related protein, which is involved in multiple cellular functions including centrosome regulation and nucleotide excision repair (NER) of DNA. Particularly to exert the latter function, complex formation with the XPC protein, the pivotal NER damage recognition factor, is crucial. Here, we show that the C-terminal half of centrin-2, containing two calcium-binding EF-hand motifs, is necessary and sufficient for both its localization to the centrosome and interaction with XPC. In XPC-deficient cells, nuclear localization of overexpressed centrin-2 largely depends on co-overexpression of XPC, and mutational analyses of the C-terminal domain suggest that XPC and the major binding partner in the centrosome share a common binding surface on the centrin-2 molecule. On the other hand, the N-terminal domain of centrin-2 also contains two EF-hand motifs but shows only low-binding affinity for calcium ions. Although the N-terminal domain is dispensable for enhancement of the DNA damage recognition activity of XPC, it contributes to augmenting rather weak physical interaction between XPC and XPA, another key factor involved in NER. These results suggest that centrin-2 may have evolved to bridge two protein factors, one with high affinity and the other with low affinity, thereby allowing delicate regulation of various biological processes.2013年08月, Nucleic acids research, 41(14) (14), 6917 - 29, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2013年07月, CANCER RESEARCH, 73(14) (14), 4362 - 4371, 英語[査読有り]研究論文(学術雑誌)
- 2013年05月, Nucleic Acids Res, 英語Structure-function analysis of the EF-hand protein centrin-2 for its intracellular localization and nucleotide excision repair.[査読有り]研究論文(学術雑誌)
- DNA double-strand breaks (DSB) occur frequently during replication in sister chromatids and are dramatically increased when cells are exposed to chemotherapeutic agents including camptothecin. Such DSBs are efficiently repaired specifically by homologous recombination (HR) with the intact sister chromatid. HR, therefore, plays pivotal roles in cellular proliferation and cellular tolerance to camptothecin. Mammalian cells carry several structure-specific endonucleases, such as Xpf-Ercc1 and Mus81-Eme1, in which Xpf and Mus81 are the essential subunits for enzymatic activity. Here, we show the functional overlap between Xpf and Mus81 by conditionally inactivating Xpf in the chicken DT40 cell line, which has no Mus81 ortholog. Although mammalian cells deficient in either Xpf or Mus81 are viable, Xpf inactivation in DT40 cells was lethal, resulting in a marked increase in the number of spontaneous chromosome breaks. Similarly, inactivation of both Xpf and Mus81 in human HeLa cells and murine embryonic stem cells caused numerous spontaneous chromosome breaks. Furthermore, the phenotype of Xpf-deficient DT40 cells was reversed by ectopic expression of human Mus81-Eme1 or human Xpf-Ercc1 heterodimers. These observations indicate the functional overlap of Xpf-Ercc1 and Mus81-Eme1 in the maintenance of genomic DNA. Both Mus81-Eme1 and Xpf-Ercc1 contribute to the completion of HR, as evidenced by the data that the expression of Mus81-Eme1 or Xpf-Ercc1 diminished the number of camptothecin-induced chromosome breaks in Xpf-deficient DT40 cells, and to preventing early steps in HR by deleting XRCC3 suppressed the nonviability of Xpf-deficient DT40 cells. In summary, Xpf and Mus81 have a substantially overlapping function in completion of HR.2013年04月, Cancer Res, 73(14) (14), 4362 - 71, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2013年04月, JOURNAL OF BIOLOGICAL CHEMISTRY, 288(15) (15), 10936 - 10947, 英語[査読有り]研究論文(学術雑誌)
- 2013年04月, JOURNAL OF BIOLOGICAL CHEMISTRY, 288(15) (15), 10936 - 10947, 英語[査読有り]研究論文(学術雑誌)
- 一般社団法人 日本生物物理学会, 2013年, 生物物理, 53(1) (1), S178, 日本語
- 2012年12月, GENES & GENETIC SYSTEMS, 87(6) (6), 411 - 411, 英語Identification of new acetylated proteins involved in DNA damage response[査読有り]
- 2012年10月, JOURNAL OF CELL BIOLOGY, 199(2) (2), 235 - 249, 英語[査読有り]研究論文(学術雑誌)
- 2012年06月, MOLECULAR AND CELLULAR BIOLOGY, 32(12) (12), 2279 - 2288, 英語[査読有り]研究論文(学術雑誌)
- 2012年06月, Mol Cell Biol, 32巻、12号、2279-2288頁, 英語Two different replication factor C proteins, Ctf18 and RFC1, separately control研究論文(学術雑誌)
- The DDB1-CUL4-RBX1 (CRL4) ubiquitin ligase family regulates a diverse set of cellular pathways through dedicated substrate receptors (DCAFs). The DCAF DDB2 detects UV-induced pyrimidine dimers in the genome and facilitates nucleotide excision repair. We provide the molecular basis for DDB2 receptor-mediated cyclobutane pyrimidine dimer recognition in chromatin. The structures of the fully assembled DDB1-DDB2-CUL4A/B-RBX1 (CRL4(DDB2)) ligases reveal that the mobility of the ligase arm creates a defined ubiquitination zone around the damage, which precludes direct ligase activation by DNA lesions. Instead, the COP9 signalosome (CSN) mediates the CRL4(DDB2) inhibition in a CSN5 independent, nonenzymatic, fashion. In turn, CSN inhibition is relieved upon DNA damage binding to the DDB2 module within CSN-CRL4(DDB2). The Cockayne syndrome A DCAF complex crystal structure shows that CRL4(DCAF(WD40)) ligases share common architectural features. Our data support a general mechanism of ligase activation, which is induced by CSN displacement from CRL4(DCAF) on substrate binding to the DCAF.2011年11月, Cell, 147(5) (5), 1024 - 39, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2011年11月, DNA Repair (ed. Kruman, I.), 453-476, 英語DNA damage recognition for mammalian global genome nucleotide excision repair.研究論文(学術雑誌)
- Translesion DNA synthesis, a process orchestrated by monoubiquitinated PCNA, is critical for DNA damage tolerance. While the ubiquitin-conjugating enzyme RAD6 and ubiquitin ligase RAD18 are known to monoubiquitinate PCNA, how they are regulated by DNA damage is not fully understood. We show that NBS1 (mutated in Nijmegen breakage syndrome) binds to RAD18 after UV irradiation and mediates the recruitment of RAD18 to sites of DNA damage. Disruption of NBS1 abolished RAD18-dependent PCNA ubiquitination and Polη focus formation, leading to elevated UV sensitivity and mutation. Unexpectedly, the RAD18-interacting domain of NBS1, which was mapped to its C terminus, shares structural and functional similarity with the RAD18-interacting domain of RAD6. These domains of NBS1 and RAD6 allow the two proteins to interact with RAD18 homodimers simultaneously and are crucial for Polη-dependent UV tolerance. Thus, in addition to chromosomal break repair, NBS1 plays a key role in translesion DNA synthesis.2011年09月, Molecular cell, 43(5) (5), 788 - 97, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- Translesion DNA synthesis, a process orchestrated by monoubiquitinated PCNA, is critical for DNA damage tolerance. While the ubiquitin-conjugating enzyme RAD6 and ubiquitin ligase RAD18 are known to monoubiquitinate PCNA, how they are regulated by DNA damage is not fully understood. We show that NBS1 (mutated in Nijmegen breakage syndrome) binds to RAD18 after UV irradiation and mediates the recruitment of RAD18 to sites of DNA damage. Disruption of NBS1 abolished RAD18-dependent PCNA ubiquitination and Polη focus formation, leading to elevated UV sensitivity and mutation. Unexpectedly, the RAD18-interacting domain of NBS1, which was mapped to its C terminus, shares structural and functional similarity with the RAD18-interacting domain of RAD6. These domains of NBS1 and RAD6 allow the two proteins to interact with RAD18 homodimers simultaneously and are crucial for Polη-dependent UV tolerance. Thus, in addition to chromosomal break repair, NBS1 plays a key role in translesion DNA synthesis.2011年09月, Molecular cell, 43(5) (5), 788 - 97, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2011年07月, DNA REPAIR, 10(7) (7), 673 - 683, 英語[査読有り]研究論文(学術雑誌)
- 2011年03月, RADIATION AND ENVIRONMENTAL BIOPHYSICS, 50(1) (1), 125 - 134, 英語[査読有り]研究論文(学術雑誌)
- 2011年01月, Biochemistry, 76: 16-23, 英語Multiple DNA damage recognition factors involved in mammalian nucleotide excision repair[査読有り]研究論文(学術雑誌)
- 2010年10月, CELL BIOCHEMISTRY AND FUNCTION, 28(7) (7), 604 - 612, 英語[査読有り]研究論文(学術雑誌)
- We showed that XPC complex, which is a DNA damage detector for nucleotide excision repair, stimulates activity of thymine DNA glycosylase (TDG) that initiates base excision repair. XPC appeared to facilitate the enzymatic turnover of TDG by promoting displacement from its own product abasic site, although the precise mechanism underlying this stimulation has not been clarified. Here we show that XPC has only marginal effects on the activity of E. coli TDG homolog (EcMUG), which remains bound to the abasic site like human TDG but does not significantly interacts with XPC. On the contrary, XPC significantly stimulates the activities of sumoylated TDG and SMUG1, both of which exhibit quite different enzymatic kinetics from unmodified TDG but interact with XPC. These results point to importance of physical interactions for stimulation of DNA glycosylases by XPC and have implications in the molecular mechanisms underlying mutagenesis and carcinogenesis in XP-C patients.2010年07月, Journal of nucleic acids, 2010, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2010年04月, NUCLEIC ACIDS RESEARCH, 38(7) (7), 英語[査読有り]研究論文(学術雑誌)
- 2010年01月, Nucleic Acids Research, 38(7) (7), e101, 英語研究論文(学術雑誌)
- For mammalian nucleotide excision repair (NER), DNA lesions are recognized in at least two steps involving detection of unpaired bases by the XPC protein complex and the subsequent verification of injured bases. Although lesion verification is important to ensure high damage discrimination and the accuracy of the repair system, it has been unclear how this is accomplished. Here, we show that damage verification involves scanning of a DNA strand from the site where XPC is initially bound. Translocation by the NER machinery exhibits a 5'-to-3' directionality, strongly suggesting involvement of the XPD helicase, a component of TFIIH. Furthermore, the initial orientation of XPC binding is crucial in that only one DNA strand is selected to search for the presence of lesions. Our results dissect the intricate molecular mechanism of NER and provide insights into a strategy for mammalian cells to survey large genomes to detect DNA damage.2009年11月, Molecular cell, 36(4) (4), 642 - 53, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2009年11月, Chembiochem : a European journal of chemical biology, 10(16) (16), 2613 - 6, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- Although the basic principle of nucleotide excision repair (NER), which can eliminate various DNA lesions, have been dissected at the genetic, biochemical and cellular levels, the important in vivo regulation of the critical damage recognition step is poorly understood. Here we analyze the in vivo dynamics of the essential NER damage recognition factor XPC fused to the green fluorescence protein (GFP). Fluorescence recovery after photobleaching analysis revealed that the UV-induced transient immobilization of XPC, reflecting its actual engagement in NER, is regulated in a biphasic manner depending on the number of (6-4) photoproducts and titrated by the number of functional UV-DDB molecules. A similar biphasic UV-induced immobilization of TFIIH was observed using XPB-GFP. Surprisingly, subsequent integration of XPA into the NER complex appears to follow only the low UV dose immobilization of XPC. Our results indicate that when only a small number of (6-4) photoproducts are generated, the UV-DDB-dependent damage recognition pathway predominates over direct recognition by XPC, and they also suggest the presence of rate-limiting regulatory steps in NER prior to the assembly of XPA.2009年06月, DNA repair, 8(6) (6), 767 - 76, 英語, 国際誌研究論文(学術雑誌)
- Although the basic principle of nucleotide excision repair (NER), which can eliminate various DNA lesions, have been dissected at the genetic, biochemical and cellular levels, the important in vivo regulation of the critical damage recognition step is poorly understood. Here we analyze the in vivo dynamics of the essential NER damage recognition factor XPC fused to the green fluorescence protein (GFP). Fluorescence recovery after photobleaching analysis revealed that the UV-induced transient immobilization of XPC, reflecting its actual engagement in NER, is regulated in a biphasic manner depending on the number of (6-4) photoproducts and titrated by the number of functional UV-DDB molecules. A similar biphasic UV-induced immobilization of TFIIH was observed using XPB-GFP. Surprisingly, subsequent integration of XPA into the NER complex appears to follow only the low UV dose immobilization of XPC. Our results indicate that when only a small number of (6-4) photoproducts are generated, the UV-DDB-dependent damage recognition pathway predominates over direct recognition by XPC, and they also suggest the presence of rate-limiting regulatory steps in NER prior to the assembly of XPA.2009年06月, DNA repair, 8(6) (6), 767 - 76, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2009年03月, Mutat. Res., 685: 19-37, 英語Regulation of damage recognition in mammalian global genomic nucleotide excision repair[査読有り]研究論文(学術雑誌)
- 2008年09月, JOURNAL OF FLUORESCENCE, 18(5) (5), 987 - 995, 英語[査読有り]研究論文(学術雑誌)
- 2008年09月, Journal of Fluorescence, 18(5) (5), 987 - 995, 英語研究論文(学術雑誌)
- 2008年03月, Carcinogenesis, 29(3) (3), 455 - 465, 英語[査読有り]研究論文(学術雑誌)
- Mutagenic radioadaptation in a human lymphoblastoid cell line.We investigated the mutagenic radioadaptive response of human lymphoblastoid TK6 cells by pretreating them with a low dose (5 cGy) of X-rays followed by a high (2 Gy) dose 6h later. Pretreatment reduced the 2-Gy-induced mutation frequency (MF) of the thymidine kinase (TK) gene (18.3 x 10(-6)) to 62% of the original level (11.4 x 10(-6)). A loss of heterozygosity (LOH) detection analysis applied to the isolated TK(-) mutants revealed the mutational events as non-LOH (resulting mostly from a point mutation in the TK gene), hemizygous LOH (resulting from a chromosomal deletion), or homozygous LOH (resulting from homologous recombination (HR) between chromosomes). For non-LOH events, pretreatment decreased the frequency to 27% of the original level (from 7.1 x 10(-6) to 1.9 x 10(-6)). cDNAs prepared from the non-LOH mutants revealed that the decrease was due mainly to the repression of base substitutions. The frequency of hemizygous LOH events, however, was not significantly altered by pretreatment. Mapping analysis of chromosome 17 demonstrated that the distribution and the extent of hemizygous LOH events were also not significantly influenced by pretreatment. For homozygous LOH events, pretreatment reduced the frequency to 61% of the original level (from 5.1 x 10(-6) to 3.1 x 10(-6)), reflecting an enhancement in HR repair of DNA double-strand breaks. Our findings suggest that the radioadaptive response in TK6 cells follows mainly from mutations at the base-sequence level, not the chromosome level.2008年02月, Mutation research, 638(1-2) (1-2), 48 - 55, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- In vivo destabilization and functional defects of the xeroderma pigmentosum C protein caused by a pathogenic missense mutation.Xeroderma pigmentosum group C (XPC) protein plays an essential role in DNA damage recognition in mammalian global genome nucleotide excision repair (NER). Here, we analyze the functional basis of NER inactivation caused by a single amino acid substitution (Trp to Ser at position 690) in XPC, previously identified in the XPC patient XP13PV. The Trp690Ser change dramatically affects the in vivo stability of the XPC protein, thereby causing a significant reduction of its steady-state level in XP13PV fibroblasts. Despite normal heterotrimeric complex formation and physical interactions with other NER factors, the mutant XPC protein lacks binding affinity for both undamaged and damaged DNA. Thus, this single amino acid substitution is sufficient to compromise XPC function through both quantitative and qualitative alterations of the protein. Although the mutant XPC fails to recognize damaged DNA, it is still capable of accumulating in a UV-damaged DNA-binding protein (UV-DDB)-dependent manner to UV-damaged subnuclear domains. However, the NER factors transcription factor IIH and XPA failed to colocalize stably with the mutant XPC. As well as highlighting the importance of UV-DDB in recruiting XPC to UV-damaged sites, these findings demonstrate the role of DNA binding by XPC in the assembly of subsequent NER intermediate complexes.2007年10月, Molecular and cellular biology, 27(19) (19), 6606 - 14, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- 2007年06月, PNE 蛋白質核酸酵素 別冊, 52(7) (7), 760 - 7, 日本語, 国内誌DNA修復におけるユビキチン化の役割研究論文(学術雑誌)
- 共立出版, 2006年11月, 蛋白質核酸酵素, 51(14) (14), 2126-2133 - 2133,1919, 日本語紫外線によるDNA損傷の修復機構
- 2006年09月, NEUROBIOLOGY OF DISEASE, 23(3) (3), 708 - 716, 英語[査読有り]研究論文(学術雑誌)
- 2006年06月, Seikagaku. The Journal of Japanese Biochemical Society, 78(6) (6), 516 - 21, 日本語, 国内誌[Repair mechanism of DNA base lesions induced by ultraviolet light irradiation].[査読有り]
- Modification of cellular proteins by the small ubiquitin-like modifier SUMO is important in regulating various cellular events. Many different nuclear proteins are targeted by SUMO, and the functional consequences of this modification are diverse. For most proteins, however, the functional and structural consequences of modification by specific SUMO isomers are unclear. Conjugation of SUMO to thymine-DNA glycosylase (TDG) induces the dissociation of TDG from its product DNA. Structure determination of the TDG central region conjugated to SUMO-1 previously suggested a mechanism in which the SUMOylation-induced conformational change in the C-terminal region of TDG releases TDG from tight binding to its product DNA. Here, we have determined the crystal structure of the central region of TDG conjugated to SUMO-3. The overall structure of SUMO-3-conjugated TDG is similar to the previously reported structure of TDG conjugated to SUMO-1, despite the relatively low level of amino acid sequence similarity between SUMO-3 and SUMO-1. The two structures revealed that the sequence of TDG that resembles the SUMO-binding motif (SBM) can form an intermolecular beta-sheet with either SUMO-1 or SUMO-3. Structural comparison with the canonical SBM shows that this SBM-like sequence of TDG retains all of the characteristic interactions of the SBM, indicating sequence diversity in the SBM.2006年05月, Journal of molecular biology, 359(1) (1), 137 - 47, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- Centrin 2 stimulates nucleotide excision repair by interacting with xeroderma pigmentosum group C protein.Xeroderma pigmentosum group C (XPC) protein plays a key role in DNA damage recognition in global genome nucleotide excision repair (NER). The protein forms in vivo a heterotrimeric complex involving one of the two human homologs of Saccharomyces cerevisiae Rad23p and centrin 2, a centrosomal protein. Because centrin 2 is dispensable for the cell-free NER reaction, its role in NER has been unclear. Binding experiments with a series of truncated XPC proteins allowed the centrin 2 binding domain to be mapped to a presumed alpha-helical region near the C terminus, and three amino acid substitutions in this domain abrogated interaction with centrin 2. Human cell lines stably expressing the mutant XPC protein exhibited a significant reduction in global genome NER activity. Furthermore, centrin 2 enhanced the cell-free NER dual incision and damaged DNA binding activities of XPC, which likely require physical interaction between XPC and centrin 2. These results reveal a novel vital function for centrin 2 in NER, the potentiation of damage recognition by XPC.2005年07月, Molecular and cellular biology, 25(13) (13), 5664 - 74, 英語, 国際誌[査読有り]
- 2005年07月, CANCER RESEARCH, 65(13) (13), 5720 - 5729, 英語Signal transducer and activator of transcription 3 is a key regulator of keratinocyte survival and proliferation following UV irradiation[査読有り]研究論文(学術雑誌)
- Crystal structure of thymine DNA glycosylase conjugated to SUMO-1.Members of the small ubiquitin-like modifier (SUMO) family can be covalently attached to the lysine residue of a target protein through an enzymatic pathway similar to that used in ubiquitin conjugation, and are involved in various cellular events that do not rely on degradative signalling via the proteasome or lysosome. However, little is known about the molecular mechanisms of SUMO-modification-induced protein functional transfer. During DNA mismatch repair, SUMO conjugation of the uracil/thymine DNA glycosylase TDG promotes the release of TDG from the abasic (AP) site created after base excision, and coordinates its transfer to AP endonuclease 1, which catalyses the next step in the repair pathway. Here we report the crystal structure of the central region of human TDG conjugated to SUMO-1 at 2.1 A resolution. The structure reveals a helix protruding from the protein surface, which presumably interferes with the product DNA and thus promotes the dissociation of TDG from the DNA molecule. This helix is formed by covalent and non-covalent contacts between TDG and SUMO-1. The non-covalent contacts are also essential for release from the product DNA, as verified by mutagenesis.2005年06月, Nature, 435(7044) (7044), 979 - 82, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- UV-induced ubiquitylation of XPC protein mediated by UV-DDB-ubiquitin ligase complex.The xeroderma pigmentosum group C (XPC) protein complex plays a key role in recognizing DNA damage throughout the genome for mammalian nucleotide excision repair (NER). Ultraviolet light (UV)-damaged DNA binding protein (UV-DDB) is another complex that appears to be involved in the recognition of NER-inducing damage, although the precise role it plays and its relationship to XPC remain to be elucidated. Here we show that XPC undergoes reversible ubiquitylation upon UV irradiation of cells and that this depends on the presence of functional UV-DDB activity. XPC and UV-DDB were demonstrated to interact physically, and both are polyubiquitylated by the recombinant UV-DDB-ubiquitin ligase complex. The polyubiquitylation altered the DNA binding properties of XPC and UV-DDB and appeared to be required for cell-free NER of UV-induced (6-4) photoproducts specifically when UV-DDB was bound to the lesion. Our results strongly suggest that ubiquitylation plays a critical role in the transfer of the UV-induced lesion from UV-DDB to XPC.2005年05月, Cell, 121(3) (3), 387 - 400, 英語, 国際誌[査読有り]
- Nucleosomal structure of undamaged DNA regions suppresses the non-specific DNA binding of the XPC complex.The XPC protein complex is a DNA damage detector of human nucleotide excision repair (NER). Although the XPC complex specifically binds to certain damaged sites, it also binds to undamaged DNA in a non-specific manner. The addition of a large excess of undamaged naked DNA competitively inhibited the specific binding of the XPC complex to (6-4) photoproducts and the NER dual incision step in cell-free extracts. In contrast, the addition of undamaged nucleosomal DNA as a competitor suppressed both of these inhibitory effects. Although nucleosomes positioned on the damaged site inhibited the binding of the XPC complex, the presence of nucleosomes in undamaged DNA regions may help specific binding of the XPC complex to damaged sites by excluding its non-specific binding to undamaged DNA regions.2005年03月, DNA repair, 4(3) (3), 389 - 95, 英語, 国際誌[査読有り]
- 一般社団法人 日本生物物理学会, 2005年, 生物物理, 45, S9, 英語
- Relative levels of the two mammalian Rad23 homologs determine composition and stability of the xeroderma pigmentosum group C protein complex.Mammalian cells express two Rad23 homologs, HR23A and HR23B, which have been implicated in regulation of proteolysis via the ubiquitin/proteasome pathway. Recently, the proteins have been shown to stabilize xeroderma pigmentosum group C (XPC) protein that is involved in DNA damage recognition for nucleotide excision repair (NER). Because the vast majority of XPC forms a complex with HR23B rather than HR23A, we investigated possible differences between the two Rad23 homologs in terms of their effects on the XPC protein. In wild-type mouse embryonic fibroblasts (MEFs), endogenous XPC was found to be relatively stable, while its steady-state level and stability appeared significantly reduced by targeted disruption of the mHR23B gene, but not by that of mHR23A. Loss of both mHR23 genes caused a strong further reduction of the XPC protein level. Quantification of the two mHR23 proteins revealed that in normal cells mHR23B is actually approximately 10 times more abundant than mHR23A. In addition, overexpression of mHR23A in the mHR23A/B double knock out cells restored not only the steady-state level and stability of the XPC protein, but also cellular NER activity to near wild-type levels. These results indicate that the two Rad23 homologs are largely functionally equivalent in NER, and that the difference in expression levels explains for a major part the difference in complex formation with as well as stabilization effects on XPC.2004年10月, DNA repair, 3(10) (10), 1285 - 95, 英語, 国際誌[査読有り]
- 2004年08月, Analytical biochemistry, 331(1) (1), 204 - 6, 英語, 国際誌研究論文(学術雑誌)
- Nucleotide excision repair of 5-formyluracil in vitro is enhanced by the presence of mismatched bases.5-Formyluracil (fU) is a major thymine lesion produced by reactive oxygen radicals and photosensitized oxidation. Although this residue is a potentially mutagenic lesion and is removed by several base excision repair enzymes, it is unknown whether fU is the substrate of nucleotide excision repair (NER). Here, we analyzed the binding specificity of XPC-HR23B, which initiates NER, and cell-free NER activity on fU opposite four different bases. The result of the gel mobility shift assay showed that XPC-HR23B binds the fU-containing substrates in the following order: fU:C > fU:T > fU:G > fU:A. Furthermore, in the presence of XPC-HR23B, the dual incision activity was the same as the order of the binding affinity of XPC-HR23B to fU. Therefore, it is concluded that even fU, regarded as a shape mimic of thymine, can be recognized as a substrate of NER incision, and the efficiency depends on instability of the base pair.2004年03月, Biochemistry, 43(10) (10), 2682 - 7, 英語, 国際誌[査読有り]
- Structure of the ubiquitin-interacting motif of S5a bound to the ubiquitin-like domain of HR23B.Ubiquitination, a modification in which single or multiple ubiquitin molecules are attached to a protein, serves signaling functions that control several cellular processes. The ubiquitination signal is recognized by downstream effectors, many of which carry a ubiquitin-interacting motif (UIM). Such interactions can be modulated by regulators carrying a ubiquitin-like (UbL) domain, which binds UIM by mimicking ubiquitination. Of them, HR23B regulates the proteasomal targeting of ubiquitinated substrates, DNA repair factors, and other proteins. Here we report the structure of the UIM of the proteasome subunit S5a bound to the UbL domain of HR23B. The UbL domain presents one hydrophobic and two polar contact sites for interaction with UIM. The residues in these contact sites are well conserved in ubiquitin, but ubiquitin also presents a histidine at the interface. The pH-dependent protonation of this residue interferes with the access of ubiquitin to the UIM and the ubiquitin-associated domain (UBA), and its mutation to a smaller residue increases the affinity of ubiquitin for UIM.2004年02月, The Journal of biological chemistry, 279(6) (6), 4760 - 7, 英語, 国際誌[査読有り]
- Translesion synthesis by human DNA polymerase eta across oxidative products of guanine.Guanine is the most oxidizable base among natural bases. 8-Oxoguanine (8-oxoG) is the typical oxidative product, but the amount of 8-oxoG does not directly reflect the strength of oxidative stress. Imidazolone, oxazolone and guanidinohydantoin are oxidative products of guanine and 8-oxoG. Here, we investigated enzymatic reactions with human DNA polymerase eta on these lesions.2004年, Nucleic acids symposium series (2004), (48) (48), 171 - 2, 英語, 国際誌[査読有り]
- Thymine-rich single-stranded DNA activates Mcm4/6/7 helicase on Y-fork and bubble-like substrates.The presence of multiple clusters of runs of asymmetric adenine or thymine is a feature commonly found in eukaryotic replication origins. Here we report that the helicase and ATPase activities of the mammalian Mcm4/6/7 complex are activated specifically by thymine stretches. The Mcm helicase is specifically activated by a synthetic bubble structure which mimics an activated replication origin, as well as by a Y-fork structure, provided that a single-stranded DNA region of sufficient length is present in the unwound segment or 3' tail, respectively, and that it carries clusters of thymines. Sequences derived from the human lamin B2 origin can serve as a potent activator for the Mcm helicase, and substitution of its thymine clusters with guanine leads to loss of this activation. At the fork, Mcm displays marked processivity, expected for a replicative helicase. These findings lead us to propose that selective activation by stretches of thymine sequences of a fraction of Mcm helicases loaded onto chromatin may be the determinant for selection of initiation sites on mammalian genomes.2003年11月, The EMBO journal, 22(22) (22), 6148 - 60, 英語, 国際誌[査読有り]
- 2003年07月, GENES & DEVELOPMENT, 17(13) (13), 1630 - 1645, 英語[査読有り]研究論文(学術雑誌)
- Elsevier, 2003年05月, DNA Repair, 2(5) (5), 639 - 652, 英語[査読有り]研究論文(国際会議プロシーディングス)
- 2003年03月, DNA REPAIR, 2(3) (3), 325 - 336, 英語DNA bending by the human damage recognition complex XPC-HR23B[査読有り]研究論文(学術雑誌)
- Xeroderma pigmentosum group C protein interacts physically and functionally with thymine DNA glycosylase.The XPC-HR23B complex recognizes various helix-distorting lesions in DNA and initiates global genome nucleotide excision repair. Here we describe a novel functional interaction between XPC-HR23B and thymine DNA glycosylase (TDG), which initiates base excision repair (BER) of G/T mismatches generated by spontaneous deamination of 5-methylcytosine. XPC-HR23B stimulated TDG activity by promoting the release of TDG from abasic sites that result from the excision of mismatched T bases. In the presence of AP endonuclease (APE), XPC-HR23B had an additive effect on the enzymatic turnover of TDG without significantly inhibiting the subsequent action of APE. Our observations suggest that XPC-HR23B may participate in BER of G/T mismatches, thereby contributing to the suppression of spontaneous mutations that may be one of the contributory factors for the promotion of carcinogenesis in xeroderma pigmentosum genetic complementation group C patients.2003年01月, The EMBO journal, 22(1) (1), 164 - 73, 英語, 国際誌[査読有り]
- The carboxy-terminal domain of the XPC protein plays a crucial role in nucleotide excision repair through interactions with transcription factor IIH.The xeroderma pigmentosum group C (XPC) protein specifically involved in genome-wide damage recognition for nucleotide excision repair (NER) was purified as a tight complex with HR23B, one of the two mammalian homologs of RAD23 in budding yeast. This XPC-HR23B complex exhibits strong binding affinity for single-stranded DNA, as well as preferential binding to various types of damaged DNA. To examine the structure-function relationship of XPC, a series of truncated mutant proteins were generated and assayed for various binding activities. The two domains participating in binding to HR23B and damaged DNA, respectively, were mapped within the carboxy-terminal half of XPC, which also contains an evolutionary conserved amino acid sequence homologous to the yeast RAD4 protein. We established that the carboxy-terminal 125 amino acids are dispensable for both HR23B and damaged DNA binding, while interactions with transcription factor IIH (TFIIH) are significantly impaired by truncation of this domain. Furthermore, deletion of the extreme carboxy-terminal domain totally abolished XPC activity in the cell-free NER reaction. These results suggest that following initial damage recognition, the carboxy terminus of XPC may be essential for the recruitment of TFIIH, and that most truncation mutations identified in XP-C patients result in non-functional proteins.2002年06月, DNA repair, 1(6) (6), 449 - 61, 英語, 国際誌[査読有り]研究論文(学術雑誌)
- Developmental defects and male sterility in mice lacking the ubiquitin-like DNA repair gene mHR23B.mHR23B encodes one of the two mammalian homologs of Saccharomyces cerevisiae RAD23, a ubiquitin-like fusion protein involved in nucleotide excision repair (NER). Part of mHR23B is complexed with the XPC protein, and this heterodimer functions as the main damage detector and initiator of global genome NER. While XPC defects exist in humans and mice, mutations for mHR23A and mHR23B are not known. Here, we present a mouse model for mHR23B. Unlike XPC-deficient cells, mHR23B(-/-) mouse embryonic fibroblasts are not UV sensitive and retain the repair characteristics of wild-type cells. In agreement with the results of in vitro repair studies, this indicates that mHR23A can functionally replace mHR23B in NER. Unexpectedly, mHR23B(-/-) mice show impaired embryonic development and a high rate (90%) of intrauterine or neonatal death. Surviving animals display a variety of abnormalities, including retarded growth, facial dysmorphology, and male sterility. Such abnormalities are not observed in XPC and other NER-deficient mouse mutants and point to a separate function of mHR23B in development. This function may involve regulation of protein stability via the ubiquitin/proteasome pathway and is not or only in part compensated for by mHR23A.2002年02月, Molecular and cellular biology, 22(4) (4), 1233 - 45, 英語, 国際誌[査読有り]
- A molecular mechanism for DNA damage recognition by the xeroderma pigmentosum group C protein complex.The XPC-HR23B complex is involved in DNA damage recognition and the initiation of global genomic nucleotide excision repair (GG-NER). Our previous studies demonstrate that XPC-HR23B recognizes and binds DNA containing a helix distortion, regardless of the presence or absence of damaged bases. Here, we describe an extended analysis of the DNA binding specificity of XPC-HR23B using various defined DNA substrates. Although XPC-HR23B showed significantly higher affinity for single-stranded DNA than double-stranded DNA, specific secondary structures of DNA, involving a single- and double-strand junction, were strongly preferred by the complex. This indicates that the presence of bases, which cannot form normal Watson-Crick base pairs in double-stranded DNA, is a critical factor in determining the specificity of XPC-HR23B binding. A DNase I footprint analysis, using a looped DNA substrate, revealed that a single XPC-HR23B complex protected a distorted site in an asymmetrical manner, consistent with the preferred secondary structure. The specific binding of XPC-HR23B is undoubtedly an important molecular process, based on which NER machinery detects a wide variety of lesions that vary in terms of chemical structure during DNA repair.2002年01月, DNA repair, 1(1) (1), 95 - 107, 英語, 国際誌[査読有り]
- 2001年06月, JOURNAL OF BIOLOGICAL CHEMISTRY, 276(22) (22), 18665 - 18672, 英語Centrosome protein centrin 2/caltractin 1 is part of the xeroderma pigmentosum group C complex that initiates global genome nucleotide excision repair[査読有り]研究論文(学術雑誌)
- 2001年04月, MUTATION RESEARCH-DNA REPAIR, 485(3) (3), 219 - 227, 英語Diversity of the damage recognition step in the global genomic nucleotide excision repair in vitro[査読有り]研究論文(学術雑誌)
- 2001年03月, GENES & DEVELOPMENT, 15(5) (5), 507 - 521, 英語A multistep damage recognition mechanism for global genomic nucleotide excision repair[査読有り]研究論文(学術雑誌)
- 2001年01月, BIOCHEMISTRY, 40(1) (1), 160 - 165, 英語Novel functional interactions between nucleotide excision DNA repair proteins influencing the enzymatic activities of TFIIH, XPG, and ERCC1-XPF[査読有り]研究論文(学術雑誌)
- 2000年04月, ONCOGENE, 19(16) (16), 1982 - 1991, 英語Retinoblastoma susceptibility protein, Rb, possesses multiple BRCT-Ws, BRCA1 carboxyl-terminus-related W regions with DNA break-binding activity[査読有り]研究論文(学術雑誌)
- 2000年03月, Mutation research, 459(2) (2), 147 - 160[査読有り]
- 2000年03月, JOURNAL OF BIOLOGICAL CHEMISTRY, 275(13) (13), 9870 - 9875, 英語The xeroderma pigmentosum group C protein complex XPC-HR23B plays an important role in the recruitment of transcription factor IIH to damaged DNA[査読有り]研究論文(学術雑誌)
- 2000年03月, MUTATION RESEARCH-DNA REPAIR, 459(2) (2), 147 - 160, 英語Reconstitution of damage DNA excision reaction from SV40 minichromosomes with purified nucleotide excision repair proteins[査読有り]研究論文(学術雑誌)
- 1999年09月, JOURNAL OF BIOLOGICAL CHEMISTRY, 274(39) (39), 28019 - 28025, 英語Interaction of hHR23 with S5a - The ubiquitin-like domain of hHR23 mediates interaction with S5a subunit of 26 S proteasome[査読有り]研究論文(学術雑誌)
- (公社)日本薬学会, 1999年03月, 日本薬学会年会要旨集, 119年会(3) (3), 114 - 114, 日本語XPC蛋白質のNER初期反応に果たす役割についての解析
- 1998年08月, GENES & DEVELOPMENT, 12(16) (16), 2598 - 2609, 英語DNA-binding polarity of human replication protein A positions nucleases in nucleotide excision repair[査読有り]研究論文(学術雑誌)
- 1998年08月, MOLECULAR CELL, 2(2) (2), 223 - 232, 英語Xeroderma pigmentosum group C protein complex is the initiator of global genome nucleotide excision repair[査読有り]研究論文(学術雑誌)
- 1997年12月, MOLECULAR AND CELLULAR BIOLOGY, 17(12) (12), 6915 - 6923, 英語Identification and characterization of XPC-binding domain of hHR23B[査読有り]研究論文(学術雑誌)
- 1997年12月, MOLECULAR AND CELLULAR BIOLOGY, 17(12) (12), 6924 - 6931, 英語Two human homologs of Rad23 are functionally interchangeable in complex formation and stimulation of XPC repair activity[査読有り]研究論文(学術雑誌)
- 1997年02月, BIOCHEMICAL SOCIETY TRANSACTIONS, 25(1) (1), 309 - 315, 英語Mammalian nucleotide excision repair and syndromes[査読有り]研究論文(学術雑誌)
- 1996年09月, MOLECULAR AND CELLULAR BIOLOGY, 16(9) (9), 4852 - 4861, 英語HHR23B, a human Rad23 homolog, stimulates XPC protein in nucleotide excision repair in vitro[査読有り]研究論文(学術雑誌)
- 1996年07月, NUCLEIC ACIDS RESEARCH, 24(13) (13), 2551 - 2559, 英語XPC and human homologs of RAD23: Intracellular localization and relationship to other nucleotide excision repair complexes[査読有り]研究論文(学術雑誌)
- 1995年09月, JOURNAL OF BIOLOGICAL CHEMISTRY, 270(38) (38), 22452 - 22459, 英語[査読有り]研究論文(学術雑誌)
- 1995年02月, JOURNAL OF BIOLOGICAL CHEMISTRY, 270(8) (8), 4152 - 4157, 英語DNA-REPAIR PROTEIN XPA BINDS REPLICATION PROTEIN-A (RPA)[査読有り]研究論文(学術雑誌)
- 1994年10月, GENOMICS, 23(3) (3), 651 - 658, 英語CHROMOSOMAL LOCALIZATION OF 3 REPAIR GENES - THE XERODERMA-PIGMENTOSUM GROUP-C GENE AND 2 HUMAN HOMOLOGS OF YEAST RAD23[査読有り]研究論文(学術雑誌)
- 1994年04月, EMBO JOURNAL, 13(8) (8), 1831 - 1843, 英語PURIFICATION AND CLONING OF A NUCLEOTIDE EXCISION-REPAIR COMPLEX INVOLVING THE XERODERMA-PIGMENTOSUM GROUP-C PROTEIN AND A HUMAN HOMOLOG OF YEAST RAD23[査読有り]研究論文(学術雑誌)
- 1993年04月, JOURNAL OF BIOLOGICAL CHEMISTRY, 268(12) (12), 9098 - 9104, 英語CELL-FREE REPAIR OF UV-DAMAGED SIMIAN VIRUS-40 CHROMOSOMES IN HUMAN CELL-EXTRACTS .1. DEVELOPMENT OF A CELL-FREE SYSTEM DETECTING EXCISION REPAIR OF UV-IRRADIATED SV40 CHROMOSOMES[査読有り]研究論文(学術雑誌)
- 1993年04月, JOURNAL OF BIOLOGICAL CHEMISTRY, 268(12) (12), 9105 - 9109, 英語CELL-FREE REPAIR OF UV-DAMAGED SIMIAN VIRUS-40 CHROMOSOMES IN HUMAN CELL-EXTRACTS .2. DEFECTIVE-DNA REPAIR SYNTHESIS BY XERODERMA-PIGMENTOSUM CELL-EXTRACTS[査読有り]研究論文(学術雑誌)
- 1993年03月, ONCOGENE, 8(3) (3), 543 - 548, 英語ABROGATION OF P53-MEDIATED TRANSACTIVATION BY SV40 LARGE T-ANTIGEN[査読有り]研究論文(学術雑誌)
- 1992年04月, CELL STRUCTURE AND FUNCTION, 17(2) (2), 113 - 122, 英語COMPLEMENTATION BY A CLONED HUMAN UBIQUITIN-ACTIVATING ENZYME E1 OF THE S-PHASE-ARRESTED MOUSE FM3A CELL MUTANT WITH THERMOLABILE E1[査読有り]研究論文(学術雑誌)
- 1992年02月, PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA, 89(3) (3), 1055 - 1059, 英語NONCONSERVATIVE SEGREGATION OF PARENTAL NUCLEOSOMES DURING SIMIAN VIRUS-40 CHROMOSOME-REPLICATION INVITRO[査読有り]研究論文(学術雑誌)
- 1992年01月, JOURNAL OF BIOLOGICAL CHEMISTRY, 267(1) (1), 462 - 466, 英語TOPOISOMERASE-II PLAYS AN ESSENTIAL ROLE AS A SWIVELASE IN THE LATE STAGE OF SV40 CHROMOSOME-REPLICATION INVITRO[査読有り]研究論文(学術雑誌)
- 1991年08月, JOURNAL OF BIOLOGICAL CHEMISTRY, 266(24) (24), 16141 - 16148, 英語REPLICATION OF THE SIMIAN VIRUS-40 CHROMOSOME WITH PURIFIED PROTEINS[査読有り]研究論文(学術雑誌)
- 1990年10月, JOURNAL OF VIROLOGY, 64(10) (10), 4820 - 4829, 英語ASSEMBLY OF NASCENT DNA INTO NUCLEOSOME STRUCTURES IN SIMIAN-VIRUS 40 CHROMOSOMES BY HELA-CELL EXTRACT[査読有り]研究論文(学術雑誌)
- 1989年10月, EUROPEAN JOURNAL OF BIOCHEMISTRY, 185(1) (1), 55 - 61, 英語HETEROGENEOUS ASSEMBLY OF NASCENT CORE HISTONES TO FORM NUCLEOSOMAL HISTONE OCTAMERS IN MOUSE FM3A CELLS[査読有り]研究論文(学術雑誌)
- 1986年12月, JOURNAL OF BIOCHEMISTRY, 100(6) (6), 1543 - 1550, 英語CHARACTERIZATION OF THE 100,000 DALTON MATERIAL PRODUCED BY CHROMATIN CROSS-LINKING REACTION WITH DITHIO-BIS(SUCCINIMIDYL PROPIONATE)[査読有り]研究論文(学術雑誌)
- 1985年12月, CELL STRUCTURE AND FUNCTION, 10(4) (4), 373 - 382, 英語RAPID PURIFICATION OF NUCLEOSOME ASSEMBLY PROTEIN (AP-I) AND PRODUCTION OF MONOCLONAL-ANTIBODIES AGAINST IT[査読有り]研究論文(学術雑誌)
- 1984年, EUROPEAN JOURNAL OF BIOCHEMISTRY, 142(3) (3), 431 - 439, 英語PURIFICATION AND INITIAL CHARACTERIZATION OF A PROTEIN WHICH FACILITATES ASSEMBLY OF NUCLEOSOME-LIKE STRUCTURE FROM MAMMALIAN-CELLS[査読有り]研究論文(学術雑誌)
- 2021年, 日本環境変異原ゲノム学会大会プログラム・要旨集, 50thゲノム中のリボヌクレオチドに対する誤りがちな修復機構の解明
- 2021年, 日本環境変異原ゲノム学会大会プログラム・要旨集, 50thDNA修復異常がもたらす過剰な免疫応答の分子機構
- 2020年, 日本分子生物学会年会プログラム・要旨集(Web), 43rdTyrosyl-DNA phosphodiesterasesはDNA中のリボヌクレオチドを起因とする突然変異形成に関与する
- Springer (eds. Nishigori Chikako and Kaoru Sugasawa), 2019年01月, DNA Repair Disorders, 1 - 23, 英語Molecular mechanism of DNA damage recognition for global genomic nucleotide excision repair: A defense system against UV-induced skin cancer[査読有り]記事・総説・解説・論説等(学術雑誌)
- Springer Singapore, 2018年01月01日, DNA Repair Disorders, 1 - 221, 英語その他
- 2018年, 日本遺伝学会大会プログラム・予稿集, 90thリボヌクレオチドが誘発する奇異突然変異とその防御機構
- 2018年, 日本環境変異原学会大会プログラム・要旨集, 47thDNA中のリボヌクレオチドが引き起こす特異な突然変異とその誘発機構の解析
- 2017年05月, JOURNAL OF INVESTIGATIVE DERMATOLOGY, 137(5) (5), S131 - S131, 英語Truncated XPA protein could not interact with TFIIH but presented mild clinical manifestations研究発表ペーパー・要旨(国際会議)
- 2017年, 日本生化学会大会(Web), 90thDNA中のリボヌクレオチドが引き起こす突然変異とその抑制機構
- 2017年, 日本環境変異原学会大会プログラム・要旨集, 46thリボヌクレオチドが誘発する突然変異の抑制におけるDNA修復機構の役割
- 技術情報協会, 2016年10月, Cosmetic stage, 11(1) (1), 9 - 15, 日本語紫外線によるDNAの損傷とがん化のメカニズム (特集 紫外線が原因で起こる皮膚トラブルと化粧品開発)
- Elsevier B.V., 2016年08月01日, DNA Repair, 44, 110 - 117, 英語[査読有り]書評論文,書評,文献紹介等
- 2016年04月, FASEB JOURNAL, 30, 英語Tripartite DNA Lesion Recognition and Verification by XPC, TFIIH, and XPA in Nucleotide Excision Repair研究発表ペーパー・要旨(国際会議)
- 2016年04月, FASEB JOURNAL, 30, 英語Tripartite DNA Lesion Recognition and Verification by XPC, TFIIH, and XPA in Nucleotide Excision Repair研究発表ペーパー・要旨(国際会議)
- Springer Japan, 2016年01月01日, DNA Replication, Recombination, and Repair: Molecular Mechanisms and Pathology, 1 - 555, 英語その他
- Springer Japan, 2016年01月01日, DNA Replication, Recombination, and Repair: Molecular Mechanisms and Pathology, v - vi, 英語その他
- Springer Japan, 2016年01月01日, DNA Replication, Recombination, and Repair: Molecular Mechanisms and Pathology, 155 - 174, 英語[査読有り][招待有り]記事・総説・解説・論説等(その他)
- 2015年12月, GENES & GENETIC SYSTEMS, 90(6) (6), 397 - 397, 英語Studies on the de-ubiquitination mechanism for the xeroderma pigmentosum group C protein in UV damage response研究発表ペーパー・要旨(国際会議)
- (公社)日本生化学会, 2015年12月, 日本生化学会大会・日本分子生物学会年会合同大会講演要旨集, 88回・38回, [3P1218] - [3P1218], 英語酸化的DNA/RNA脱メチル化酵素ALKBH3の機能解析
- 日本癌学会, 2015年10月, 日本癌学会総会記事, 74回, P - 3148, 英語酸化的DNA/RNA脱メチル化酵素ALKBH3の発現変化は細胞増殖や代謝に影響を与える
- 2015年04月, DNA REPAIR, 28, 144 - 144, 英語Post-translational modifications coordinating recognition and repair of UV-induced DNA damage研究発表ペーパー・要旨(国際会議)
- 2015年, 日本生化学会大会(Web), 88thヌクレオチド除去修復を制御するタンパク質リン酸化の解析
- 2015年, 日本生化学会大会(Web), 88th塩基除去修復因子チミンDNAグリコシラーゼの構造活性相関と機能制御
- 2014年12月, GENES & GENETIC SYSTEMS, 89(6) (6), 312 - 312, 英語Studies on the de-ubiquitylation mechanism of the xeroderma pigmentosum group C protein研究発表ペーパー・要旨(国際会議)
- 2014年10月, JOURNAL OF DERMATOLOGY, 41, 14 - 14, 英語GENOTYPE -PHENOTYPE CORRELATION AMONG XERODERMA PIGMENTOSUM COMPLEMENTATION GROUP D研究発表ペーパー・要旨(国際会議)
- 2014年08月31日, 日本遺伝学会大会プログラム・予稿集, 86th, 99, 日本語紫外線損傷修復におけるXPCタンパク質の脱ユビキチン化機構の解析
- 2014年, 日本分子生物学会年会プログラム・要旨集(Web), 37thヌクレオチド除去修復におけるDNA損傷認識機構の解析
- 2013年12月, GENES & GENETIC SYSTEMS, 88(6) (6), 361 - 361, 英語A novel function of FANCD2 protein in apoptosis signaling研究発表ペーパー・要旨(国際会議)
- (公社)日本生化学会, 2013年09月, 日本生化学会大会プログラム・講演要旨集, 86回, 2T14a - 07, 日本語紫外線損傷DNAを含むヌクレオソームの生化学的および構造生物学的解析
- 2012年12月, GENES & GENETIC SYSTEMS, 87(6) (6), 386 - 386, 英語Studies on the de-ubiquitylation mechanism of the xeroderma pigmentosum group C protein研究発表ペーパー・要旨(国際会議)
- 2012年10月, JOURNAL OF CELL BIOLOGY, 199(2) (2), 235 - 249, 英語[査読有り]記事・総説・解説・論説等(学術雑誌)
- (一社)日本放射線影響学会, 2012年09月, 日本放射線影響学会大会講演要旨集, 55回, 126 - 126, 日本語紫外線によるDNA損傷の修復を促進するDDB2の構造と機能制御
- 2012年08月31日, 日本遺伝学会大会プログラム・予稿集, 84th, 100, 日本語DNA損傷応答に関わる新規アセチル化標的タンパク質の同定
- 2012年08月31日, 日本遺伝学会大会プログラム・予稿集, 84th, 72, 日本語紫外線損傷修復におけるXPCタンパク質の脱ユビキチン化機構の解析
- 放射線生物研究会, 2012年06月, 放射線生物研究, 47(2) (2), 95 - 111, 日本語ヌクレオチド除去修復におけるDNA損傷認識の分子基盤
- 2012年, 日本分子生物学会年会プログラム・要旨集(Web), 35th無細胞再構成系によるヌクレオチド除去修復活性制御因子の探索
- 2012年, 日本分子生物学会年会プログラム・要旨集(Web), 35thゲノム安定維持に関わるcentrin-2の新たな機能
- 2012年, 日本分子生物学会年会プログラム・要旨集(Web), 35th, 2W5II-1 (WEB ONLY), 日本語DNA損傷によるヒトRad52タンパク質のアセチル化は,DNA二重鎖切断部位への集積に必要である
- 2012年, 日本分子生物学会年会プログラム・要旨集(Web), 35th, 1P-0201 (WEB ONLY), 日本語ヒト間葉系幹細胞におけるヒトRad52タンパク質のDNA損傷によるアセチル化誘導
- 2011年07月, DNA REPAIR, 10(7) (7), 673 - 683, 英語書評論文,書評,文献紹介等
- 2011年, DNA repair, Vol. , No. , pp. 453-476, 英語DNA damage recognition for mammalian global genome nucleotide excision repair[査読有り]記事・総説・解説・論説等(学術雑誌)
- 2011年01月, BIOCHEMISTRY-MOSCOW, 76(1) (1), 16 - 23, 英語[査読有り]書評論文,書評,文献紹介等
- (公社)日本生化学会, 2010年12月, 日本生化学会大会・日本分子生物学会年会合同大会講演要旨集, 83回・33回, 1T12 - 9, 英語DNA損傷認識蛋白質DDB2のN末端領域の機能解析(Functional analysis of the N-terminal domain of the DNA damage recognition protein DDB2)
- 2010年02月, GENES & GENETIC SYSTEMS, 85(1) (1), 86 - 86, 英語Genotoxic stress targets Fanconi anemia group D2 protein for fragmentation by the caspase-mediated pathway研究発表ペーパー・要旨(国際会議)
- 2009年08月, DNA REPAIR, 8(8) (8), 969 - 972, 英語[査読有り]記事・総説・解説・論説等(学術雑誌)
- 2009年08月, Mutat Res., 685(1-2):29-37, 29 - 37Regulation of damage recognition in mammalian global genomic nucleotide excision repair.[査読有り]記事・総説・解説・論説等(学術雑誌)
- 2009年05月, MOLECULAR CELL, 34(4) (4), 403 - 404, 英語[査読有り]その他
- 医歯薬出版, 2009年01月, 医学のあゆみ, 228: 137-142(2) (2), 137 - 142, 日本語色素性乾皮症遺伝子産物によるDNA損傷認識機構[査読有り]記事・総説・解説・論説等(学術雑誌)
- 2009年, Journal of Radiation Research, 50(5) (5), 407 - 413, 英語[査読有り]書評論文,書評,文献紹介等
- 2008年03月, CARCINOGENESIS, 29(3) (3), 455 - 465, 英語書評論文,書評,文献紹介等
- 2007年10月, NATURE STRUCTURAL & MOLECULAR BIOLOGY, 14(10) (10), 887 - 888, 英語その他
- 2007年10月, Nature structural & molecular biology, 14(10) (10), 887 - 8, 英語, 国際誌Sensing of DNA damage by XPC/Rad4: one protein for many lesions.[査読有り]記事・総説・解説・論説等(学術雑誌)
- 2007年, 生化学, 3W23-3, 日本語ヌクレオチド除去修復における損傷認識とユビキチン化
- 2006年09月, JOURNAL OF MOLECULAR HISTOLOGY, 37(5-7) (5-7), 189 - 202, 英語書評論文,書評,文献紹介等
- 放射線生物研究会, 2005年12月20日, 放射線生物研究, 40(4) (4), 345 - 359, 日本語クロマチン構造を介したヌクレオチド除去修復
- 日本環境変異原学会, 2005年, 日本環境変異原学会大会プログラム・要旨集, (34) (34), 78 - 78, 英語S2-2 細胞がん化に対する防御機構としてのDNA損傷の認識と修復(シンポジウム(2)「細胞がん化のブラックボックスに挑む」)
- 2004年11月25日, 日本分子生物学会年会プログラム・講演要旨集, 27th, 637, 日本語XPC複合体およびUV‐DDBの損傷DNA結合活性に対するヌクレオソーム構造の影響
- 2004年05月, CELL STRUCTURE AND FUNCTION, 29, 63 - 63, 英語Functional analysis of centrin2 in XPC protein complex研究発表ペーパー・要旨(国際会議)
- 2004年05月, CELL STRUCTURE AND FUNCTION, 29, 11 - 11, 英語Ubiquitylation of XPC protein by DDB-E3 complex研究発表ペーパー・要旨(国際会議)
- 2003年11月25日, 日本分子生物学会年会プログラム・講演要旨集, 26th, 497, 日本語ヌクレオソーム構造によるXPC蛋白質複合体の非特異的DNA結合の抑制はヌクレオチド除去修復の特異性を高める
- 2003年10月06日, 日本放射線影響学会大会講演要旨集, 46th, 126, 日本語XPC‐HR23Bの非特異的DNA結合はヌクレオソーム構造によって抑制される
- 2003年, NMR討論会講演要旨集, 42ndHR23Bユビキチン相同ドメイン-プロテアソームS5aサブユニットユビキチン結合モチーフ複合体の構造解析
- 2003年, 日本分子生物学会年会プログラム・講演要旨集, 26thプロテアソームS5aサブユニットユビキチン結合モチーフとhHR23Bユビキチン相同ドメイン複合体の構造解析
- the Japan Radiation Research Society, 2003年, Journal of radiation research, 44(4) (4), 405 - 405, 英語74 Nucleosome structure suppresses non-specific DNA binding of XPC-HR23B(Radiation sensitivities in cells & tissues, Abstracts of the 46th Annual Meeting of the Japan Radiation Research Society) :
- 2002, May2002年05月28日, Biochemistry, 41(21) (21), 6583 - 7, 英語, 国際誌[査読有り]
- the Japan Radiation Research Society, 2002年, Journal of radiation research, 43(4) (4), 416 - 416, 英語Functions of the DNA Damage Recognition Factor for Mammalian Nucleotide Excision Repair :
- 2001年07月31日, Tissue culture research communications : the journal of experimental & applied cell culture research = 組織培養研究, 20(2) (2), 105 - 105, 日本語C群色素性乾皮症(XPC)タンパク質の生細胞核内でのタンパク質間の相互作用と局在
- 2000年10月, 宇宙生物科学 = Biological sciences in space, 14(3) (3), 264 - 265, 日本語細胞内タンパク質 : タンパク質相互作用に対する重力影響の検討
- 日本組織培養学会, 2000年06月30日, Tissue culture research communications : the journal of experimental & applied cell culture research = 組織培養研究, 19(2) (2), 68 - 68, 日本語ヌクレオチド除去修復能欠損ヒト繊維芽細胞を用いたDNA損傷後細胞周期調節の解析
- 1998年12月01日, 日本分子生物学会年会プログラム・講演要旨集, 21, 371 - 371, 日本語XPC-hHR23B蛋白質複合体の損傷DNA結合活性の解析
- 1998年12月01日, 日本分子生物学会年会プログラム・講演要旨集, 21, 371 - 371, 日本語ヌクレオチド除去修復におけるXPC蛋白質複合体の機能
- 1998年12月01日, 日本分子生物学会年会プログラム・講演要旨集, 21, 370 - 370, 日本語XPC機能ドメインの解析
- 1998年12月01日, 日本分子生物学会年会プログラム・講演要旨集, 21, 371 - 371, 日本語ヌクレオチド除去修復因子hHR23A/Bと26Sプロテアソーム制御因子S5aの相互作用の解析
- 1996年08月, 日本分子生物学会年会プログラム・講演要旨集, 19, 75 - 75, 日本語真核細胞ヌクレオチド除去修復の分子機構
- 1996年08月01日, 日本分子生物学会年会プログラム・講演要旨集, 19, 778 - 778, 日本語XPC-HHR23B複合体の機能の解析
- 1996年08月01日, 日本分子生物学会年会プログラム・講演要旨集, 19, 778 - 778, 日本語XPC/HHR23B蛋白質合体の相互作用
- 1991年01月, EXPERIMENTAL CELL RESEARCH, 192(1) (1), 110 - 117, 英語
- 1987年12月, CELL STRUCTURE AND FUNCTION, 12(6) (6), 649 - 649, 英語CORRELATION BETWEEN CELL-PROLIFERATION AND REGULARITY OF NUCLEOSOME STRUCTURE研究発表ペーパー・要旨(国際会議)
- 共著, 技術情報協会, 2016年10月, 日本語紫外線によるDNAの損傷とがん化のメカニズム一般書・啓蒙書
- 共編者(共編著者), Springer, 2016年, 英語DNA Replication, Recombination and Repair: Molecular Mechanisms and Pathology学術書
- 共著, シーエムシー出版, 2015年04月, 日本語光老化科学の最前線学術書
- 共著, InTech, 2007年10月, 英語DNA Repair (Kruman, I. ed.)学術書
- Springer, 英語, ISBN: 9789811067211DNA Repair disorders
- 第42回染色体ワークショップ・第23回核ダイナミクス研究会, 2025年01月, 日本語DNA の構造的要因から探るヌクレオチド除去修復制御機構ポスター発表
- 日本環境変異原ゲノム学会第53回大会, 2024年12月, 日本語脂肪族アルデヒドの代謝異常がゲノム安定性に及ぼす影響[招待有り]口頭発表(招待・特別)
- 第47回日本分子生物学会年会, 2024年11月, 日本語CRL4Cdt2のDNA合成部位への適切な集積と解離が細胞周期進行を制御するポスター発表
- 第47回日本分子生物学会年会, 2024年11月, 日本語クライオ電子顕微鏡によるクロマチン上の紫外線損傷修復メカニズムの解明口頭発表(一般)
- 第47回日本分子生物学会年会, 2024年11月, 日本語ヌクレオチド除去修復のDNA損傷認識制御におけるヒストン修飾の役割ポスター発表
- 第47回日本分子生物学会年会, 2024年11月, 日本語酸化的RNA損傷を鋳型としたSARS-CoV-2由来RNA依存性RNAポリメラーゼのRNA合成機構の解明ポスター発表
- 第47回日本分子生物学会年会, 2024年11月, 日本語アルデヒド脱水素酵素ALDH3A2の欠損がゲノム安定性に及ぼす影響ポスター発表
- 第47回日本分子生物学会年会, 2024年11月, 日本語ヌクレオチド除去修復のDNA損傷認識を制御するクロマチン構造変換機構ポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語Impacts of heavy water on DNA double-strand break repairs and cellular transcription, potentially via quantum-level mechanisms underlying kinetic isotope effectsポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語The involvement of chromatin remodeling factor SMACRAD1 in response to DNA double strand breaks[招待有り]ポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語Impact of histone modifications on damage recognition process of global genome nucleotide excision repairポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語Cryo-EM analyses of UV-damaged recognition protein UV-DDB in nucleosomes during nucleotide excision repairポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語Cooperation of Cdt2 C-terminal motifs in regulating CRL4Cdt2 dynamics at the DNA replication siteポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語Contribution of translesion synthesis for mutagenesis via a novel food-induced formamidopyrimidine-derivativeポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語Effects of DNA substrate structures on lesion excision by nucleotide excision repair in vitro[招待有り]ポスター発表
- The12th 3R+3C International Symposium, 2024年11月, 英語The agile dance of XP proteins in nucleotide excision repair[招待有り]口頭発表(招待・特別)
- The12th 3R+3C International Symposium, 2024年11月, 英語Chromatin dynamics regulating DNA damage recognition for nucleotide excision repair[招待有り]口頭発表(招待・特別)
- 日本放射線影響学会第67回大会, 2024年09月, 日本語ヌクレオチド除去修復の損傷認識制御におけるヒストン修飾の役割口頭発表(一般)
- 日本放射線影響学会第67回大会, 2024年09月, 日本語ヌクレオチド除去修復におけるDNA損傷認識の制御機構口頭発表(一般)
- 日本放射線影響学会第67回大会, 2024年09月, 日本語クライオ電子顕微鏡による細胞内クロマチン上のDNA損傷修復機構の理解口頭発表(一般)
- 日本放射線影響学会第67回大会, 2024年09月, 日本語重水によるDNA二重鎖切断修復阻害は、加水分解酵素反応に対する量子レベルの速度論的同位体効果によると推測される口頭発表(一般)
- 第83回日本癌学会学術総会, 2024年09月, 日本語アクリルアミドの活性代謝物であるグリシドアミドのホルムアミドピリミジン誘導体による突然変異誘発機序口頭発表(一般)
- 第31回日本免疫毒性学会学術年会, 2024年09月, 日本語DNA修復の機能不全によるDNA鎖切断を伴わない自然免疫応答メカニズムの解明ポスター発表
- 第31回日本免疫毒性学会学術年会, 2024年09月, 日本語DNA鎖切断に起因するインターフェロン応答における核酸センサーcGAS,IFI16の役割口頭発表(一般)
- Gutenberg Workshop RNase H 2024: Structures, Functions and Disorders, 2024年09月, 英語Uncovering distinct DNA damage responses associated with RNase H2 deficiency and its pathogenic mutation in human TK6 cells
- 55th Annual Meeting of the EMGS, 2024年09月, 英語In vitro RNA synthesis past oxidative base damage by SARS-CoV-2 RNA-dependent RNA polymerase口頭発表(一般)
- 7th DNA Polymerases Meeting, 2024年08月, 英語Contribution of translesion synthesis for mutagenesis via a novel food-induced formamidopyrimidine-derivativeポスター発表
- 第51回日本毒性学会学術年会, 2024年07月, 日本語グリシドアミド付加体のホルムアミドピリミジン誘導体はDNA複製阻害と突然変異を誘発するポスター発表
- 日本薬学会年第144年会, 2024年03月, 日本語グリシドアミド付加体のホルムアミドピリミジン誘導体はDNA複製阻害と突然変異を誘発するポスター発表
- 第41回染色体ワークショップ・第22回核ダイナミクス研究会, 2024年01月, 日本語ヌクレオチド除去修復における損傷クロマチン認識機構の構造基盤と理解ポスター発表
- 第41回染色体ワークショップ・第22回核ダイナミクス研究会, 2024年01月, 日本語損傷クロマチン基質を用いたヌクレオチド除去修復制御機構の生化学的解析ポスター発表
- 第41回染色体ワークショップ・第22回核ダイナミクス研究会, 2024年01月, 日本語ヌクレオチド除去修復の損傷監視制御におけるヒストン修飾の役割口頭発表(一般)
- 第46回日本分子生物学会年会, 2023年12月, 日本語細胞の⽣存は量⼦効果に⽀配されているポスター発表
- 第46回日本分子生物学会年会, 2023年12月, 日本語ヌクレオチド除去修復のDNA損傷認識制御におけるヒストンH3K9メチル化修飾の役割ポスター発表
- 第46回日本分子生物学会年会, 2023年12月, 日本語紫外線誘発DNA損傷に対する細胞応答におけるクロマチンリモデリング因⼦SMARCAD1の関与ポスター発表
- 第46回日本分子生物学会年会, 2023年12月, 日本語DNAポリメラーゼ‧イータの発現調節における脱ユビキチン化酵素USP11の関与ポスター発表
- 第46回日本分子生物学会年会, 2023年12月, 日本語ゲノム全体を対象としたヌクレオチド除去修復の損傷認識を制御するクロマチン動態口頭発表(一般)
- 第46回日本分子生物学会年会, 2023年12月, 日本語⾷品汚染物質アクリルアミドの活性代謝物により⽣じるホルムアミドピリミジン誘導体の突然変異誘発機構口頭発表(一般)
- 第46回日本分子生物学会年会, 2023年12月, 日本語ヒストン翻訳後修飾を介したXPCタンパク質の核内局在制御ポスター発表
- 第46回日本分子生物学会年会, 2023年12月, 日本語ヌクレオチド除去修復のDNA損傷認識を制御するクロマチン構造変換機構ポスター発表
- 日本環境変異原ゲノム学会第52回大会, 2023年11月, 日本語DNA損傷を起因とした過剰なインターフェロン応答の分子経路の同定ポスター発表
- 日本環境変異原ゲノム学会第52回大会, 2023年11月, 日本語ゲノムDNAに蓄積したリボヌクレオチドが誘発するゲノム不安定化の分子機構ポスター発表
- 赤川真崇、Petr Grúz、菅澤 薫、浦 聖恵、佐々 彰, 2023年11月, 日本語SARS-CoV-2におけるRNA依存性RNAポリメラーゼの損傷乗り越えRNA合成機構の解析ポスター発表
- 日本環境変異原ゲノム学会第52回大会, 2023年11月, 日本語脂肪族アルデヒド脱水素酵素の欠損により生じる細胞毒性の解析ポスター発表
- 日本環境変異原ゲノム学会第52回大会, 2023年11月, 日本語脂肪族アルデヒド脱水素酵素のゲノム安定性維持における影響口頭発表(一般)
- 日本放射線影響学会第66回大会, 2023年11月, 日本語クライオ電子顕微鏡による紫外線損傷修復機構の構造基盤の理解口頭発表(一般)
- 日本放射線影響学会第66回大会, 2023年11月, 日本語ヌクレオチド除去修復の正確性を保証するDNA損傷認識の分子構造基盤口頭発表(一般)
- 日本放射線影響学会第66回大会, 2023年11月, 日本語ゲノム全体を対象としたヌクレオチド除去修復の損傷認識制御におけるヒストン修飾の役割口頭発表(一般)
- 日本遺伝学会第95回大会, 2023年09月, 日本語損傷クロマチン基質を用いたヌクレオチド除去修復制御機構の生化学的解析ポスター発表
- 日本遺伝学会第95回大会, 2023年09月, 日本語ヌクレオチド除去修復の正確性を保証するDNA損傷認識の分子構造基盤口頭発表(一般)
- 第27回DNA複製・組換え・修復ワークショップ, 2023年06月, 日本語ヌクレオチド除去修復の損傷認識制御におけるヒストン修復の役割口頭発表(一般)
- 量子生命科学会第5回大会, 2023年05月, 日本語量子効果の想定外の大きな影響:細胞の生存は量子効果に支配されているポスター発表
- The 19th Ataxia-Telangiectasia Workshop (ATW2023), 2023年03月, 英語Histone modifications regulating the initiation of global genome nucleotide excision repairポスター発表
- 若手フロンティア研究会2022, 2022年12月, 日本語損傷クロマチン基質におけるヌクレオチド除去修復開始制御機構の解析ポスター発表
- 第45回日本分子生物学会年会, 2022年12月, 日本語ヒストン修飾を介したヌクレオチド除去修復の損傷認識促進機構ポスター発表
- 第45回日本分子生物学会年会, 2022年12月, 日本語ヒストン修飾を介したヌクレオチド除去修復の損傷認識促進機構口頭発表(一般)
- 第45回日本分子生物学会年会, 2022年11月, 日本語脂質代謝制御におけるファンコニ貧血タンパク質の機能解析ポスター発表
- 第45回日本分子生物学会年会, 2022年11月, 日本語ヌクレオチド除去修復におけるDNA損傷認識を制御するクロマチン構造変換因子複合体ポスター発表
- 第45回日本分子生物学会年会, 2022年11月, 日本語脂質代謝制御におけるファンコニ貧血タンパク質の機能解析口頭発表(一般)
- 日本環境変異原ゲノム学会第51回大会, 2022年11月, 日本語Understanding the Molecular Mechanism of Innate Immune Response Caused by DNA Repair Deficiencyポスター発表
- 日本環境変異原ゲノム学会第51回大会, 2022年11月, 日本語γH2AXの多角的解析による内因性DNA二本鎖切断の定量評価ポスター発表
- 日本環境変異原ゲノム学会第51回大会, 2022年11月, 日本語ゲノム中リボヌクレオチドの蓄積が誘発するDNA二本鎖切断の修復機構ポスター発表
- 第49回国際核酸化学シンポジウム, 2022年11月, 英語Ring-Opened N7-deoxyguanosine adduct of glycidamide induces DNA replication inhibition and mutagenesisポスター発表
- 2022 International IBS Conference for Genomic Integrity, 2022年10月, 英語Roles of histone modifications in DNA damage recognition initiating global genome nucleotide excision repairポスター発表
- 2022 International IBS Conference for Genomic Integrity, 2022年10月, 英語Chromatin dynamics regulating initiation of nucleotide excision repair[招待有り]口頭発表(招待・特別)
- International Conference of the Genetics Society of Korea 2022 (ICGSK2022), 2022年10月, 英語Chromatin dynamics regulating initiation of nucleotide excision repair[招待有り]口頭発表(招待・特別)
- International Conference of the Genetics Society of Korea 2022 (ICGSK2022), 2022年10月, 英語Roles of histone modifications in DNA damage recognition initiating global genome nucleotide excision repairポスター発表
- 日本放射線影響学会第65回大会, 2022年09月, 日本語ヌクレオチド除去修復における紫外線誘発DNA損傷の効率的な認識に寄与するヒストン修飾口頭発表(一般)
- 日本薬学会第142年会, 2022年03月, 日本語損傷乗り越え型DNAポリメラーゼPolκとREV1はグリシドアミドN7位デオキシグアノシン付加体による点突然変異に寄与するポスター発表
- 第39回染色体ワークショップ・第20回核ダイナミクス研究会, 2021年12月, 日本語色素性乾皮症C群タンパク質によるDNA損傷認識を制御するクロマチン動態ポスター発表
- 第39回染色体ワークショップ・第20回核ダイナミクス研究会, 2021年12月, 日本語ヒストン脱アセチル化はヌクレオチド除去修復におけるDNA損傷認識を制御するポスター発表
- 第44回日本分子生物学会年会, 2021年12月, 日本語ヒストン脱アセチル化はヌクレオチド除去修復におけるDNA損傷認識を制御するポスター発表
- 第44回日本分子生物学会年会, 2021年12月, 日本語脱ユビキチン化酵素による損傷乗り越え合成の制御機構の解析ポスター発表
- 第44回日本分子生物学会年会, 2021年12月, 日本語ファンコニ貧血タンパク質の脂質代謝における機能解析ポスター発表
- 第44回日本分子生物学会年会, 2021年12月, 日本語色素性乾皮症C群タンパク質によるDNA損傷認識を制御するクロマチン動態ポスター発表
- 第44回日本分子生物学会年会, 2021年12月, 日本語グリシドアミドN7位デオキシグアノシン付加体による点突然変異に寄与する損傷乗り越え型DNAポリメラーゼの解析口頭発表(一般)
- 第44回日本分子生物学会年会, 2021年12月, 日本語DNA損傷修復において機能するCRL4ユビキチンリガーゼの損傷部位集積機構のライブイメージ解析ポスター発表
- 第94回日本生化学会大会, 2021年11月, 日本語ヌクレオチド除去修復におけるDNA損傷認識を制御するクロマチンダイナミクス口頭発表(一般)
- 第26回DNA複製・組換え・修復ワークショップ, 2021年10月, 日本語ゲノム安定性維持に関わるCRL4Cdt2ユビキチンリガーゼの損傷部位集積機構の解析口頭発表(一般)
- 日本放射線影響学会第 64 回大会, 2021年09月, 日本語紫外線誘発DNA損傷の効率的な認識と修復を保障するヒストン修飾の役割口頭発表(一般)
- 日本遺伝学会第93回大会, 2021年09月, 日本語ヌクレオチド除去修復の損傷認識を補助するクロマチン構造変換機構の解明口頭発表(一般)
- 第1回広帯域極限電磁波生命理工連携研究会, 2021年09月, 日本語光刺激を用いたゲノムDNA損傷応答の研究[招待有り]口頭発表(招待・特別)
- 第43回日本分子生物学会年会, 2020年12月, 日本語DNA損傷認識タンパク質DDB2による新たなクロマチン動態制御機構の解明ポスター発表
- 第43回日本分子生物学会年会, 2020年12月, 日本語Tyrosyl-DNA phosphodiesterasesはDNA中のリボヌクレオチドを起因とする突然変異形成に関与するポスター発表
- 日本環境変異原学会第49回大会, 2020年11月, 日本語脂質代謝におけるファンコニ貧血タンパク質の機能解析口頭発表(一般)
- 日本遺伝学会第92回大会, 2020年09月, 日本語色素性乾皮症タンパク質による紫外線誘発DNA損傷認識の生体内制御機構口頭発表(一般)
- 第47回日本毒性学会学術年会, 2020年06月, 英語The N7-glycidamide adduct of 2’-deoxyguanosine on the template strand induces DNA replication inhibition and mutagenesis in human cellsポスター発表
- 4th DNA Repair/Replication Structures and Cancer Conference, 英語Functional analysis of histone modifications regulating recognition of DNA lesions in nucleotide excision repair.ポスター発表
- 第42回日本分子生物学会年会, 日本語ヌクレオソーム上における DNAスライドを介した新たな紫外線損傷認識メカニズムの解明ポスター発表
- 第42回日本分子生物学会年会, 日本語N7-グリシドアミドdG付加体により誘発されるDNA複製阻害と変異原性の解析ポスター発表
- 第42回日本分子生物学会年会, 日本語RNAを介したヌクレオチド除去修復制御機構の解析ポスター発表
- 第42回日本分子生物学会年会, 日本語脂質代謝に応答したファンコニ貧血タンパク質のダイナミクスポスター発表
- 第42回日本分子生物学会年会, 日本語ファンコニ貧血タンパク質FANCD2と脂質代謝関連因子の機能的連関の解析ポスター発表
- 第42回日本分子生物学会年会, 日本語DNAポリメラーゼ・イータと脱ユビキチン化酵素の相互作用の解析ポスター発表
- 第42回日本分子生物学会年会, 日本語TLSポリメラーゼの損傷部位への導入過程を生細胞イメージングにより解 析する試みポスター発表
- 第42回日本分子生物学会年会, 日本語XPCタンパク質によるDNA損傷認識の制御とヒストン修飾の役割ポスター発表
- 第42回日本分子生物学会年会, 日本語ヌクレオチド除去修復の損傷認識を制御するクロマチン構造変換因子の探 索ポスター発表
- 金沢大学薬学シンポジウム2019「多様な生体防御システム研究のイノベーション〜アンメット・メディカル・ニーズから創薬へ〜」, 2019年11月, 日本語ゲノムの安定維持を保証するDNA損傷認識の高次制御機構[招待有り]口頭発表(招待・特別)
- 6th Asian Congress on Environmental Mutagens (ACEM) and 48th Annual Meeting of the Japanese Environmental Mutagen Society (JEMS), 英語Mechanistic insight of unique mutations caused by a ribonucleotide embedded into DNA.ポスター発表
- 6th Asian Congress on Environmental Mutagens (ACEM) and 48th Annual Meeting of the Japanese Environmental Mutagen Society (JEMS), 英語Alternate processing pathways of a single ribonucleotide incorporated into DNA and its consequences in human cells.口頭発表(一般)
- 6th Asian Congress on Environmental Mutagens (ACEM) and 48th Annual Meeting of the Japanese Environmental Mutagen Society (JEMS), 英語Chromatin dynamics regulating DNA lesion recognition in nucleotide excision repair口頭発表(一般)
- 日本放射線影響学会第62回大会, 英語Functional analysis of histone modifications regulating recognition of UV-induced DNA lesions in nucleotide excision repair.口頭発表(一般)
- Symposium of the Biosignal Research Center and the KAITAKU Project "Genome Function in Higher-Order Life Phenomena", Kobe University), 2019年11月, 英語Roles for ATPase activities of transcription factor IIH in nucleotide excision repair.口頭発表(一般)
- International Symposium on "Maintenance of Genome Integrity" (Joint Symposium of the Biosignal Research Center and the KAITAKU Project "Genome Function in Higher-Order Life Phenomena", Kobe University), 2019年11月, 英語Functional analysis of chromatin remodeling machinery regulating recognition of DNA lesions in nucleotide excision repair.口頭発表(一般)
- 第25回DNA複製・組換え・修復ワークショップ, 日本語ヌクレオチド除去修復の損傷認識を制御するヒストン修飾の解析口頭発表(一般)
- サイエンスフロンティア研究発表会, 2019年10月, 日本語TLSポリメラーゼの生細胞イメージングとその定量解析への取り組みポスター発表
- 9th Asia and Oceania Conference on Photobiology, 英語Molecular mechanism of recognition and repair of UV-induced DNA damage.[招待有り]口頭発表(基調)
- 2019 Fanconi Anemia Scientific Symposium, 英語Dynamics of FANCD2 in response to lipid metabolism.ポスター発表
- 17th International Congress on Photobiology and 18th Congress of the European Society for Photobiology, 英語Chromatin dynamics regulating recognition of UV-induced DNA photolesions.口頭発表(一般)
- 第135回日本薬理学会近畿部会, 2019年06月, 日本語皮膚老化メカニズムの解明とその応用ポスター発表
- International Symposium on XP and other Nucleotide Excision Repair Disorders, 2019年03月, 英語, Cambridge, U.K., 国際会議In vivo regulation of DNA damage recognition for nucleotide excision repair[招待有り]口頭発表(招待・特別)
- 日本環境変異原学会第47回大会, 2018年11月, 日本語, 京都, 国内会議脂肪族アルデヒド代謝におけるファンコニ貧血タンパク質の機能解析口頭発表(一般)
- 日本放射線影響学会第61回大会, 2018年11月, 日本語, 長崎, 国内会議紫外線誘発DNA損傷修復の高次制御機構口頭発表(一般)
- 第41回日本分子生物学会年会, 2018年11月, 日本語, 横浜, 国内会議ファンコニ貧血タンパク質FANCD2と脂質代謝関連因子の相互作用解析ポスター発表
- 第41回日本分子生物学会年会, 2018年11月, 日本語, 横浜, 国内会議XPCタンパク質によるDNA損傷認識の制御におけるヒストン修飾の役割ポスター発表
- The 11th 3R&3C Symposium, 2018年11月, 英語, Kanazawa Japan, 国際会議Translesion synthesis-associated chromatin remodeling factors contribute the function of human DNA polymerase η in cisplatin-treated cells.口頭発表(一般)
- The 11th 3R&3C Symposium, 2018年11月, 英語, Kanazawa Japan, 国際会議Functional analysis of histone modification in DNA damage recognition process of nucleotide excision repair.口頭発表(一般)
- 日本環境変異原学会第47回大会, 2018年11月, 日本語, 京都, 国内会議DNA中のリボヌクレオチドが引き起こす特異な突然変異とその誘発機構の 解析ポスター発表
- 第41回日本分子生物学会年会, 2018年11月, 日本語, 横浜, 国内会議DNAポリメラーゼ・イータと脱ユビキチン化酵素の相互作用の解析ポスター発表
- 日本遺伝学会第90回大会, 2018年09月, 日本語, 奈良, 国内会議リボヌクレオチドが誘発する奇異突然変異とその防御機構口頭発表(一般)
- 第91回日本生化学会大会, 2018年09月, 日本語, 京都, 国内会議ヌクレオチド除去修復の損傷認識を制御するクロマチン構造変換機構の解明口頭発表(一般)
- 第91回日本生化学会大会, 2018年09月, 日本語, 京都, 国内会議ヌクレオチド除去修復のDNA損傷認識を制御するクロマチン構造動態口頭発表(一般)
- 第91回生化学会大会, 2018年09月, 日本語, 京都, 国内会議クロマチン構造を介したヌクレオチド除去修復の高次制御機構口頭発表(一般)
- 日本遺伝学会第90回大会, 2018年09月, 日本語, 奈良, 国内会議Functional impact of ubiquitin-proteasome system on UV-induced DNA damage response and repair口頭発表(一般)
- 日本薬学会第138年会, 2018年03月, 日本語, 石川県立音楽堂他全9会場, 国内会議ヌクレオチド除去修復におけるDNA損傷認識の高次制御機構口頭発表(一般)
- International Meeting on RECQ Helicases and Related Diseases 2018, 2018年02月, 英語, かずさアカデミアパーク, 国際会議Coordinated DNA damage recognition by xeroderma pigmentosum gene products[招待有り]口頭発表(招待・特別)
- 2017年度生命科学系学会合同年次大会, 2017年12月, 日本語, 神戸国際会議場, 国内会議ヌクレオチド除去修復の開始を制御するクロマチン構造の役割口頭発表(一般)
- 2017年度生命科学系学会合同年次大会, 2017年12月, 日本語, 神戸国際会議場, 国内会議ヌクレオチド除去修復における損傷認識機構の解析ポスター発表
- 日本環境変異原学会第46回大会, 2017年11月, 日本語, 一橋大学 一橋講堂, 国内会議脂質アルデヒド代謝におけるファンコニ貧血タンパク質の機能解析ポスター発表
- 第24回DNA複製・組換え・修復ワークショップ, 2017年11月, 日本語, 長良川国際会議場, 国内会議ユビキチン-プロテアソーム系による紫外線誘発DNA損傷応答制御口頭発表(一般)
- 第24回DNA複製・組換え・修復ワークショップ, 2017年11月, 日本語, 長良川国際会議場, 国内会議ヌクレオチド除去修復の開始を制御するクロマチン構造の役割口頭発表(一般)
- 第24回DNA複製・組換え・修復ワークショップ, 2017年11月, 日本語, 長良川国際会議場, 国内会議ヌクレオチド除去修復におけるDNA損傷認識機構の解析口頭発表(一般)
- 第24回 DNA複製・組換え・修復ワークショップ, 2017年11月, 日本語, 長良川国際会議場, 国内会議シスプラチン誘発DNA鎖内架橋の乗り越え合成に関わるヒストン修飾とクロマチン構造変換因子の探索ポスター発表
- The 2nd Biosignal Research Center International Symposium, 2017年11月, 英語, Kobe University, 国際会議Mechanism and regulation of DNA damage recognition in nucleotide excision repair口頭発表(一般)
- ICEM-ACEM 2017, 2017年11月, 英語, Songdo Convensia/Seoul South Korea, 国際会議Chromatin dynamics regulating DNA damage recognition of nucleotide excision repair[招待有り]口頭発表(招待・特別)
- 2017 FA Scientific Symposium, 2017年09月, 英語, Grand Hyatt Atlanta in Buckhead/Atlanta USA, 国際会議Fatty aldehyde dehydrogenase as a novel binding partner of FANCD2[招待有り]口頭発表(招待・特別)
- 第76回 日本癌学会, 2017年09月, 日本語, パシフィコ横浜, 国内会議Chromatin remodeling factors contribute to the function of human DNA polymerase η in the cells treated with cisplatinポスター発表
- 6th US-Japan DNA Repair Meeting, 2017年05月, 英語, Berkeley University of California/ Berkeley, USA, 国際会議Interaction of DNA damage recognition factors with chromatin.[招待有り]口頭発表(招待・特別)
- 第27回太陽紫外線防御研究委員会シンポジウム, 2017年03月, 日本語, 太陽紫外線防御研究委員会, 大阪, 国内会議紫外線DNA損傷修復の分子機構[招待有り]口頭発表(招待・特別)
- Japan-Swiss Symposium on Chromatin Structure and Dynamics, 2017年01月, 英語, Basel, Switzerland, 国際会議Interaction of DNA damage recognition factors with the chromatin structure口頭発表(一般)
- 第39回日本分子生物学会年会(MBSJ2016), 2016年11月, 日本語, 日本分子生物学会, 横浜, 国内会議タンパク質分解系による紫外線誘発DNA損傷応答制御ポスター発表
- The 10th 3R Symposium, 2016年11月, 英語, The 10th 3R Symposium Organizing Committee, Matsue, Shimane, Japan, 国際会議Roles of DNA topology and TFIIH ATPases in mammalian nucleotide excision repair口頭発表(一般)
- 第39回日本分子生物学会年会(MBSJ2016), 2016年11月, 日本語, 日本分子生物学会, 横浜, 国内会議Molecular mechanism ensuring accuracy of the nucleotide excision repair system口頭発表(一般)
- The 10th 3R Symposium, 2016年11月, 英語, The 10th 3R Symposium Organizing Committee, Matsue, Shimane, Japan, 国際会議Functional impact of ubiquitin-proteasome system on UV-induced DNA damage response and repairポスター発表
- 第39回日本分子生物学会年会(MBSJ2016), 2016年11月, 日本語, 日本分子生物学会, 横浜, 国内会議FANCD2新規相互作用因子の探索と機能解析口頭発表(一般)
- 第39回日本分子生物学会年会(MBSJ2016), 2016年11月, 日本語, 日本分子生物学会, 横浜, 国内会議DNA損傷認識を制御するクロマチン構造動態ポスター発表
- 第39回日本分子生物学会年会(MBSJ2016), 2016年11月, 日本語, 日本分子生物学会, 横浜, 国内会議DNAのトポロジー状態がヌクレオチド除去修復に及ぼす影響ポスター発表
- 第89回日本生化学会大会, 2016年09月, 日本語, 日本分子生物学会, 仙台, 国内会議ヌクレオチド除去修復のDNA損傷認識とその制御の分子基盤口頭発表(一般)
- Symposium: Celebration Jan Hoeijmakers, 2016年09月, 英語, Rotterdam, The Netherlands, 国際会議Studies on nucleotide excision repair:beginning with XPC and beyond[招待有り]口頭発表(招待・特別)
- KSBMB (Korean Society for Biochemistry and Molecular Biology) International Conference 2016, 2016年05月, 英語, KSBMB, Seoul, Korea, 国際会議DNA damage recognition mechanism for mammalian nucleotide excision repair[招待有り]口頭発表(招待・特別)
- Conference on Responses to DNA Damage: from Molecule to Disease, 2016年04月, 英語, Egmond aan Zee, The Netherlands, 国際会議Dynamics of chromatin structure regulating nucleotide excision repairポスター発表
- Conference on Responses to DNA Damage: from Molecule to Disease, 2016年04月, 英語, Egmond aan Zee, The Netherlands, 国際会議Dissection of the DNA damage recognition machinery in mammalian nucleotide excision repair[招待有り]口頭発表(招待・特別)
- 第13回SUMO研究会, 2016年01月, 日本語, SUMO研究会, 大阪, 国内会議3R研究の今後の動向について口頭発表(一般)
- 第13回SUMO研究会, 2016年01月, 日本語, SUMO研究会, 大阪, 国内会議3R研究の今後の動向について口頭発表(一般)
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議酸化的DNA/RNA脱メチル化酵素ALKBH3の機能解析ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議酸化的DNA/RNA脱メチル化酵素ALKBH3の機能解析ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議塩基除去修復因子チミンDNAグリコシラーゼの構造活性相関と機能制御ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議塩基除去修復因子チミンDNAグリコシラーゼの構造活性相関と機能制御ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヒトメディエーター複合体hMED17サブユニットによる転写制御とDNA損傷修復機能の解明ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヒトメディエーター複合体hMED17サブユニットによる転写制御とDNA損傷修復機能の解明ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヒトRAD52のアセチル化を介した相同組換えにおけるアセチル化および脱アセチル化酵素の新規機能の解明口頭発表(一般)
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヒトRAD52のアセチル化を介した相同組換えにおけるアセチル化および脱アセチル化酵素の新規機能の解明口頭発表(一般)
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヌクレオチド除去修復を制御するタンパク質リン酸化の解析ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヌクレオチド除去修復を制御するタンパク質リン酸化の解析ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヌクレオチド除去修復を制御するクロマチン構造動態の解析ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヌクレオチド除去修復を制御するクロマチン構造動態の解析ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヌクレオチド除去修復の細胞内制御機構とその多様性口頭発表(一般)
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ヌクレオチド除去修復の細胞内制御機構とその多様性口頭発表(一般)
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議タンパク質分解系による紫外線損傷応答制御口頭発表(一般)
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議タンパク質分解系による紫外線損傷応答制御口頭発表(一般)
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ゲノム損傷応答におけるp53とDDB2の機能連関ポスター発表
- 第38回日本分子生物学会年会・第88回日本生化学会大会合同大会(BMB2015), 2015年12月, 日本語, 日本分子生物学会, 神戸, 国内会議ゲノム損傷応答におけるp53とDDB2の機能連関ポスター発表
- 第74回日本癌学会学術総会, 2015年10月, 日本語, 日本癌学会, 名古屋, 国内会議紫外線誘発DNA損傷の修復促進と皮膚癌の抑制に関わる分子機構口頭発表(一般)
- 第74回日本癌学会学術総会, 2015年10月, 日本語, 日本癌学会, 名古屋, 国内会議紫外線誘発DNA損傷の修復促進と皮膚癌の抑制に関わる分子機構口頭発表(一般)
- 第74回日本癌学会学術総会, 2015年10月, 日本語, 日本癌学会, 名古屋, 国内会議酸化的DNA/RNA脱メチル化酵素ALKBH3の発現変化は細胞増殖や代謝に影響を与えるポスター発表
- 第74回日本癌学会学術総会, 2015年10月, 日本語, 日本癌学会, 名古屋, 国内会議酸化的DNA/RNA脱メチル化酵素ALKBH3の発現変化は細胞増殖や代謝に影響を与えるポスター発表
- 第23回DNA複製・組換え・修復ワークショップ, 2015年10月, 日本語, 焼津, 国内会議ユビキチンープロテアソーム系による紫外線誘発DNA損傷応答制御口頭発表(一般)
- 第23回DNA複製・組換え・修復ワークショップ, 2015年10月, 日本語, DNA複製・組換え・修復ワークショップ研究会, 焼津, 国内会議ユビキチンープロテアソーム系による紫外線誘発DNA損傷応答制御口頭発表(一般)
- 日本遺伝学会第87回大会, 2015年09月, 日本語, 日本遺伝学会, 仙台, 国内会議紫外線損傷修復におけるXPCタンパク質の脱ユビキチン化制御機構の解析口頭発表(一般)
- 日本遺伝学会第87回大会, 2015年09月, 日本語, 日本遺伝学会, 仙台, 国内会議紫外線損傷修復におけるXPCタンパク質の脱ユビキチン化制御機構の解析口頭発表(一般)
- 15th International Congress of Radiation Research, 2015年05月, 英語, 京都, 国際会議Molecular mechanism of DNA damage recognition in mammalian nucleotide excision repair.口頭発表(一般)
- 15th International Congress of Radiation Research, 2015年05月, 英語, ICRR, 京都, 国際会議Molecular mechanism of DNA damage recognition in mammalian nucleotide excision repair.口頭発表(一般)
- 日本薬学会第135年会, 2015年03月, 日本語, 神戸学院大学, 国内会議ヌクレオチド除去修復の制御に関わるクロマチン構造動態口頭発表(一般)
- The Mammalian DNA Repair Gordon Research Conference 2015, 2015年02月, 英語, Four Points Sheraton / Holiday Inn Express, 国際会議In Vivo Regulation of Mammalian Nucleotide Excision Repair[招待有り]口頭発表(招待・特別)
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議哺乳類ヌクレオチド除去修復タンパク質XPCのDNA結合モードの1分子イメージング口頭発表(一般)
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議翻訳後修飾を介した色素性乾皮症遺伝子産物の機能制御口頭発表(一般)
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議遺伝性疾患の分子病態:分子機能から高次生命機能へ口頭発表(一般)
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議ヒトRAD52タンパク質のアセチル化制御ポスター発表
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議ヌクレオチド除去修復におけるDNA損傷認識機構の解析ポスター発表
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議ヌクレオソームにおける紫外線損傷塩基の収納およびその認識機構の解析ポスター発表
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議ゲノム損傷応答におけるGadd45αの機能解析ポスター発表
- The 9th 3R Symposium Together with National Instituite of Genetics 2014 International Symposium, 2014年11月, 英語, 御殿場高原ホテル, 国際会議SUMO regulates DNA damage recognition in nucleotide excision repairポスター発表
- The 9th 3R Symposium Together with National Instituite of Genetics 2014 International Symposium, 2014年11月, 英語, 御殿場高原ホテル, 国際会議Studies on the de-ubiquitination mechanism of the xeroderma pigmentosum group C proteinポスター発表
- The 9th 3R Symposium Together with National Instituite of Genetics 2014 International Symposium, 2014年11月, 英語, 御殿場高原ホテル, 国際会議Post-translational modifications coordinating recognition and repair of UV-induced DNA damage口頭発表(一般)
- The 9th 3R Symposium Together with National Instituite of Genetics 2014, 2014年11月, 英語, 御殿場高原ホテル, 国際会議Functional regulation of thymine DNA glycosylase involved in DNA repair and epigenetic reprogrammingポスター発表
- The 9th 3R Symposium 2014, 2014年11月, 英語, 3R organizing committee, 御殿場, 国際会議Functional interactions between XPC and DDB2 in nucleotide excision repairポスター発表
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議DNA損傷応答におけるDDB2の翻訳後修飾の機能解析ポスター発表
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議DNA修復・損傷応答におけるクロマチン構造ダイナミクスの解析ポスター発表
- 第37回日本分子生物学会年会, 2014年11月, 日本語, パシフィコ横浜, 国内会議DNA修復とエピゲノム制御に関わるチミンDNAグリコシラーゼの機能制御ポスター発表
- 日本放射線影響学会第57回大会, 2014年10月, 日本語, かごしま県民交流センター, 国内会議紫外線誘発DNA損傷修復の細胞内制御機構口頭発表(一般)
- 第87回日本生化学会大会, 2014年10月, 日本語, 国立京都国際会館, 国内会議ヌクレオチド除去修復におけるXPCとDDB2の機能的相互作用口頭発表(一般)
- 第5回日米修復会議, 2014年10月, 英語, グランドエクシブ鳴門, 国際会議Post-translational modifications coordinating recognition and repair of UV-induced DNA damage.口頭発表(一般)
- 日本遺伝学会第86回大会, 2014年09月, 日本語, 長浜バイオ大学, 国内会議紫外線損傷修復におけるXPCタンパク質の脱ユビキチン化機構の解析ポスター発表
- 3rd Eastern Asia Dermatology Congress, 2014年09月, 英語, Eastern Asia Dermatology Congress, Jeju, Korea, 韓国, 国際会議Genotype -Phenotype Correlation Among Xeroderma Pigmentosum Complementation Group D.シンポジウム・ワークショップパネル(公募)
- 第36回日本光医学・光生物学会, 2014年07月, 日本語, 日本光医学・光生物学会, 大阪, 国内会議細胞の紫外線損傷DNA修復能の蛍光検出口頭発表(一般)
- International Symposium on Xeroderma Pigmentosum and Related Diseases, 2014年03月, 英語, Kobe, Japan, 国際会議SUMO regulates DNA damage recognition in nucleotide excision repairポスター発表
- International Symposium on Xeroderma Pigmentosum and Related Diseases, 2014年03月, 英語, Kobe, Japan, 国際会議Roles for post-translational protein modifications in regulation of DNA damage recognition for mammalian nucleotide excision repair口頭発表(一般)
- International Symposium on Xeroderma Pigmentosum and Related Diseases, 2014年03月, 英語, Kobe, Japan, 国際会議Molecular analysis of DNA repair defects in cells from Japanese patients with xeroderma pigmentosum Group Dポスター発表
- International Symposium on Xeroderma Pigmentosum and Related Diseases, 2014年03月, 英語, Kobe, Japan, 国際会議Functional interactions between XPC and DDB2 through ubiquitylation in DNA damage responsesポスター発表
- International Symposium on Xeroderma Pigmentosum and related diseases, 2014年03月, 英語, Kobe, 国際会議A child case of xeroderma pigmentosum group D.ポスター発表
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 日本分子生物学会, 神戸, 国内会議哺乳類ヌクレオチド除去修復におけるDNA損傷認識課程の制御口頭発表(一般)
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 神戸, 国内会議哺乳類ヌクレオチド除去修復タンパク質XPCの1分子イメージング:DNA上での1次元自由拡散運動の観察ポスター発表
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 日本分子生物学会, 神戸, 国内会議酸化的脱メチル化酵素ALKBH2/3の発現変化が細胞増殖・代謝に及ぼす影響ポスター発表
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 神戸, 国内会議ヌクレオチド除去修復の損傷認識に関わるクロマチン構造制御ポスター発表
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 神戸, 国内会議FANCD2タンパク質はアポトーシスを抑制的に制御する口頭発表(一般)
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 神戸, 国内会議DNA脱メチル化酵素TDGのSUMO化修飾による機能制御ポスター発表
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 神戸, 国内会議DNA損傷応答におけるXPCとDDB2のユビキチン化を介した機能連関ポスター発表
- 厚生労働省科学研究費「神経皮膚症候群に関する調査研究班」平成25年度総会, 2013年12月, 日本語, 神経皮膚症候群に関する調査研究班, 東京, 国内会議DNA修復異常を伴う光線過敏症患者の分子細胞生物学的解析その他
- 第36回日本分子生物学会年会, 2013年12月, 日本語, 神戸, 国内会議DNA修復とエピゲノム制御に関わるチミンDNAグリコシラーゼの機能制御ポスター発表
- 第31回染色体ワークショップ・第12回核ダイナミクス研究会, 2013年11月, 日本語, 箱根, 国内会議ファンコニ貧血症タンパク質FANCD2によるアポトーシス制御機構口頭発表(一般)
- 第22回DNA複製・組換え・修復ワークショップ, 2013年11月, 日本語, 仙台, 国内会議ファンコニ貧血症タンパク質FANCD2によるアポトーシス制御機構ポスター発表
- 第22回 DNA 複製・組換え・修復ワークショップ, 2013年11月, 日本語, 国内会議ヌクレオチド除去修復における損傷認識機構とSUMO化修飾の意義口頭発表(一般)
- International Symposium on Transcription and Metabolism, 2013年11月, 英語, Awaji, Japan, 国際会議Manipulated expression of the oxidative DNA/RNA demethylation enzymes ALKBH2/3 alters cellular proliferation and metabolism.口頭発表(一般)
- International Symposium on Transcription and Metabolism, 2013年11月, 英語, Awaji, Japan, 国際会議Functional regulation of thymine DNA glycosylase involved in DNA repair and epigenetic reprogramming口頭発表(一般)
- International Symposium on Transcription and Metabolism, 2013年11月, 英語, Awaji, Japan, 国際会議Functional interactions of DNA damage repair with transcriptional and epigenetic regulation口頭発表(一般)
- 第22回DNA複製・組換え・修復ワークショップ, 2013年11月, 日本語, 仙台, 国内会議DNA損傷応答におけるXPCとDDB2のユビキチン化を介した機能連関口頭発表(一般)
- International Symposium on Transcription and Metabolism, 2013年11月, 英語, Awaji, Japan, 国際会議Chromatin structure regulating DNA damage recognition in nucleotide excision repair口頭発表(一般)
- 第51回日本生物物理学会年会, 2013年10月, 日本語, 京都, 国内会議哺乳類ヌクレオチド除去修復タンパク質XPCの1分子イメージングポスター発表
- 日本放射線影響学会第56回大会, 2013年10月, 日本語, 青森, 国内会議紫外線誘発DNA損傷の修復機構におけるSUMO化修飾の役割口頭発表(一般)
- 第36回日本分子生物学会年会, 2013年10月, 日本語, 神戸, 国内会議酸化的脱メチル化酵素ALKBH2/3の発現変化が細胞増殖・代謝に及ぼす影響ポスター発表
- 第1回がんと代謝研究会, 2013年10月, 日本語, 鶴岡, 国内会議メチル化塩基修飾酵素ALKBH2/3の発現変化が代謝に与える影響ポスター発表
- 第86回日本生化学会大会, 2013年09月, 日本語, 横浜, 国内会議ゲノムDNA損傷の修復と細胞応答を制御するタンパク質翻訳後修飾の役割口頭発表(一般)
- 第22回日本Cell Death学会学術集会, 2013年07月, 日本語, 京都, 国内会議FANCD2はDNA修復に関わる機能とは独立してTNFα/TNFR1を介したアポトーシス機構を負に制御している口頭発表(一般)
- 第36回日本分子生物学会年会, 2013年, 英語, 神戸, 国内会議Regulation of the DNA damage recognition machinery in mammalian nucleotide excision repair口頭発表(一般)
- 日本遺伝学会第85回大会, 2013年, 日本語, 横浜, 国内会議FANCD2遺伝子産物はDNA修復とは独立したアポトーシス抑制機能を有する口頭発表(一般)
- 第35回日本分子生物学会年会, 2012年12月, 日本語, 福岡, 国内会議The Functional Analysis of the Modifications of the DNA Damage Recognition Protein DDB2(2W5II-6)口頭発表(基調)
- 第35回 日本分子生物学会年会 ポスター発表, 2012年12月, 日本語, 国内会議Roles of sumoylation in regulation of the xeroderma pigmantosum group C protein口頭発表(一般)
- 第35回日本分子生物学会年会, 2012年12月, 日本語, 福岡, 国内会議Novel function of RFC complexes in genome stability through PCNA-CRL4Cdt2 mediated (3W5III-5) Cdt1Degradation During DNA Replication.口頭発表(基調)
- 第30回染色体ワークショップ, 2012年12月, 日本語, 淡路, 国内会議FANCD2 タンパク質はアポトーシスを抑制的に制御するシンポジウム・ワークショップパネル(公募)
- 第35回日本分子生物学会年会, 2012年12月, 日本語, 福岡, 国内会議Exploration of Novel Regulatory Factors in Mammalian Nucleotide Excision Repair (1ST3-018)ポスター発表
- 第85回日本生化学会, 2012年12月, 日本語, 福岡, 国内会議Elucidation of a Linkage Between Ubiquitin E3 Ligase RNF4 and a Component of the (1ST3-022) Thymine DNA Glycosylase TDG-containing DNA Demethylation Complex.ポスター発表
- 第35回日本分子生物学会年会, 2012年12月, 日本語, 日本分子生物学会, 福岡, 国内会議DNA damage induced-acetylation of human Rad52 protein is required for appropriate accumulation of the protein at DNA double-strand break sites.口頭発表(基調)
- 第35回日本分子生物学会年会, 2012年12月, 日本語, 日本分子生物学会, 福岡, 国内会議DNA damage-induced acetylation of human Rad52 protein in human mesenchymal stem cellsポスター発表
- 第35回日本分子生物学会年会, 2012年12月, 日本語, 日本分子生物学会, 福岡, 国内会議A novel function of FANCD2 protein in apoptosis signaling (2ST2-026)ポスター発表
- 第35回日本分子生物学会, 2012年12月, 日本語, 福岡, 国内会議A novel function of centrin-2 involved in maintenance of genomic stability.口頭発表(一般)
- 第35回日本分子生物学会年会, 2012年12月, 日本語, 日本分子生物学会, 福岡, 国内会議A novel function of centrin-2 involved in maintenance of genomic stability口頭発表(基調)
- The 8th 3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2012年11月, 英語, Awaji, 国際会議SUMO regulates DNA damage recognition in nucleotide excision repair.シンポジウム・ワークショップパネル(公募)
- The 8th 3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2012年11月, 英語, Awaji, 国際会議Genotoxic stress induces caspase-mediated cleavage of the FANCD2 protein.シンポジウム・ワークショップパネル(公募)
- The 8th 3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2012年11月, 英語, Awaji, 国際会議Functional studies on ubiquitylation of the DNA damage recognition protein DDB2シンポジウム・ワークショップパネル(公募)
- 第10回SUMO 研究会, 2012年11月, 日本語, SUMO 研究会, 熊本, 国内会議DNA損傷応答とSUMO/ubiquitin口頭発表(一般)
- The 8th 3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2012年11月, 英語, Awaji, 国際会議DNA repair synthesis defect in xeroderma pigmentosum group D cells.シンポジウム・ワークショップパネル(公募)
- 日本遺伝学会第84回大会, 2012年09月, 日本語, 福岡, 国内会議紫外線損傷修復におけるXPCタンパク質の脱ユビキチン化機構の解析口頭発表(一般)
- 日本放射線影響学会第55回大会, 2012年09月, 日本語, 仙台, 国内会議紫外線によるDNA損傷の修復を促進するDDB2の構造と機能制御口頭発表(一般)
- 第71回日本癌学会学術総会, 2012年09月, 日本語, 札幌, 国内会議Functional regulation of the DNA damage recognition factor DDB2 via post-translational modifications.口頭発表(一般)
- 第34回日本光医学・光生物学会, 2012年07月, 日本語, 神戸大学大学院医学研究科, 神戸, 国内会議紫外線誘発DNA損傷の認識と修復の分子基盤[招待有り]口頭発表(招待・特別)
- US-JAPAN DNA Repair Meeting, 2012年04月, 英語, Virginia, USA, 国際会議Post-Translational Protein Modification Regulating Mammalian Nucleotide Excision Repair.[招待有り]口頭発表(招待・特別)
- DNA Repair Mini-Symposium, 2012年04月, 英語, Maryland, USA, 国際会議Molecular mechanism of DNA damage recognition in mammalian nucleotide excision repair.[招待有り]口頭発表(招待・特別)
- 国立遺伝学研究所研究集会「ユビキチン・SUMOによるDNA複製およびDNA修復系の制御」, 2012年02月, 日本語, 国立遺伝学研究所, 三島, 国内会議タンパク質翻訳後修飾によるDNA損傷認識の制御口頭発表(一般)
- 第29回染色体ワークショップ, 2012年01月, 日本語, 仙台, 国内会議DNA損傷ストレスに伴うFANCD2タンパク質のカスパーゼ依存的切断口頭発表(一般)
- Kobe University-University of Washington Joint Symposium on Integrative Membrane Biology and Signal Transduction Medeicine, 2011年12月, 英語, 神戸, 国際会議Roles for sumoylation in regulation of the xeroderma pigmentosum group C proteinポスター発表
- 第34回日本分子生物学会年会, 2011年12月, 日本語, 日本分子生物学会, 横浜, 国内会議Roles for sumoylation in regulation of the xeroderma pigmentosum group C protein口頭発表(一般)
- 第34回日本分子生物学会年会, 2011年12月, 日本語, 日本分子生物学会, 横浜, 国内会議Regulation of active DNA demethylation enzyme, the thymine DNA glycosylase TDG, by SUMOylation and ubiquitinylation口頭発表(一般)
- 第34回日本分子生物学会年会, 2011年12月, 日本語, 日本分子生物学会, 横浜, 国内会議Reconstitution of mammalian nucleotide excision repair:molecular basis for DNA damage recognition口頭発表(一般)
- 第34回日本分子生物学会年会, 2011年12月, 日本語, 日本分子生物学会, 横浜, 国内会議New function of PCNA loaders, RFC1-RFC and Ctf18-RFC, in genome stability through PCNA-CRL4-mediated Cdt1 degradation口頭発表(一般)
- 第34回日本分子生物学会年会, 2011年12月, 日本語, 日本分子生物学会, 横浜, 国内会議Genotoxic stress induces caspase-mediated cleavage of the FANCD2 protein口頭発表(一般)
- 第34回日本分子生物学会年会, 2011年12月, 日本語, 日本分子生物学会, 横浜, 国内会議Functional analysis of the CRL4 DDB2 E3 ligase in mammalian nucleotide excision repair口頭発表(一般)
- 第27回RBC-NIRS国際シンポジウム, 2011年12月, 英語, Kyoto University, コープイン京都, 国際会議DNA damage recognition in nucleotide excision repair: molecular mechanism and involvement of chromatin structure.[招待有り]口頭発表(招待・特別)
- 日本放射線影響学会第54回大会, 2011年11月, 日本語, 日本放射線影響学会, 神戸, 国内会議ヌクレオチド除去修復におけるDNA損傷認識の分子基盤[招待有り]口頭発表(招待・特別)
- Taiwan-Japan Joint Symposium on Cell Signaling and Gene Regulation, 2011年11月, 英語, National Cheng Kung University, Tainan, Taiwan, 国際会議Regulationn of DNA repair through post-translational protein modifications.[招待有り]口頭発表(招待・特別)
- 第12回Wakoつくばフォーラム, 2011年11月, 日本語, 和光純薬工業, 筑波和光ホール, 国内会議DNA損傷修復とエピゲノム制御のクロストーク[招待有り]口頭発表(招待・特別)
- 第10回核ダイナミクス研究会, 2011年10月, 日本語, 核ダイナミクス研究会, 北海道 北広島, 国内会議ヌクレオチド除去修復の損傷認識機構におけるSUMO化修飾の役割口頭発表(一般)
- 平成23年度遺伝研研究会「クロマチンダイナミクスの分子機構」, 2011年10月, 日本語, 国立遺伝学研究所, 三島, 国内会議ヌクレオチド除去修復におけるDNA損傷認識機構とUV-DDBの役割[招待有り]口頭発表(招待・特別)
- 第84回日本生化学会大会, 2011年09月, 日本語, 日本生化学会, 国立京都国際会館, 国内会議SUMO認識型ユビキチンリガーゼRNF4によるTDGグリコシラーゼを含むDNA脱メチル化酵素複合体の機能制御口頭発表(一般)
- 構造エピゲノム研究会第4回ワークショップ「DNA損傷とエピゲノム」, 2011年07月, 日本語, 構造エピゲノム研究会, 理化学研究所横浜研究所交流棟ホール, 国内会議UV-DDB:ヌクレオチド除去修復とエピゲノム制御のクロスロード[招待有り]口頭発表(招待・特別)
- Conference on Responses to DNA Damage: from Molecular Mechanism to Human Disease, 2011年04月, 英語, Organizing Committee, Conference on Responses to DNA damage, Egmond aan Zee, The Netherlands, 国際会議Regulation of DNA damage recognition in mammalian NER[招待有り]口頭発表(招待・特別)
- 第33回日本分子生物学会年会, 2010年12月, 日本語, 日本分子生物学会, 神戸ポートアイランド, 国内会議複製と損傷に応答して機能するユビキチンリガーゼ、CRL4Cdt2の制御機構口頭発表(一般)
- 第33回日本分子生物学会年会・第83回日本生化学会大会合同大会, 2010年12月, 日本語, 日本分子生物学会, 神戸ポートアイランド, 国内会議Functional analysis of the N-terminal domain of the DNA damage recognition protein DDB2口頭発表(一般)
- 第33回日本分子生物学会年会・第83回日本生化学会大会合同大会, 2010年12月, 日本語, 日本分子生物学会, 神戸ポートアイランド, 国内会議DNA損傷ストレスに伴うFANCD2タンパク質のカスパーゼ依存的切断口頭発表(一般)
- 第33回日本分子生物学会年会・第83回日本生化学会大会合同大会, 2010年12月, 日本語, 日本分子生物学会, 神戸ポートアイランド, 国内会議A 19S proteasome subunit PSMD14 is involved in deubiquitination of XPCポスター発表
- The 7th 3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2010年10月, 英語, 第7回3Rシンポジウム実行委員会, 富山国際会議場, 国内会議Roles for centrin-2 in DNA damage recognition for global genome nucleotide excision repair口頭発表(一般)
- The 7th 3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2010年10月, 英語, 第7回3Rシンポジウム実行委員会, 富山, 国内会議Genotoxic stress induces caspase-mediated cleavage of the FANCD2 proteinポスター発表
- 第69回日本癌学会学術総会, 2010年09月, 日本語, 日本癌学会, 大阪, 国内会議色素性乾皮症遺伝子産物によるDNA損傷認識の分子基盤口頭発表(一般)
- 国立遺伝学研究所研究集会「ユビキチン・SUMOによるDNA複製およびDNA修復系の制御」, 2010年09月, 日本語, 国立遺伝学研究所, 三島, 国内会議ヌクレオチド除去修復におけるcentrin2の機能解析口頭発表(一般)
- 第9回核ダイナミクス研究会, 2010年05月, 日本語, 核ダイナミクス研究会, 伊豆, 国内会議ゲノム全体を監視するDNA損傷認識の分子基盤口頭発表(一般)
- International Conference on Radiation and Cancer Biology at Nagasaki 2010, 2010年02月, 英語, Nagasaki University, 長崎, 国際会議DNA damage recognition mechanism for mammalian nucleotide excision repair口頭発表(招待・特別)
- 第32回日本分子生物学会年会, 2009年12月, 英語, 日本分子生物学会, パシフィコ横浜, 国内会議Post-translational modification of XPC protein controls global genome nucleotide excision repairポスター発表
- 第32回日本分子生物学会年会, 2009年12月, 日本語, 日本分子生物学会, パシフィコ横浜, 国内会議Genotoxic stress targets Fanconi anemia group D2 protein for fragmentation by the caspase-mediated pathwayポスター発表
- 第32回日本分子生物学会年会, 2009年12月, 日本語, 日本分子生物学会, パシフィコ横浜, 国内会議Fluorescence detection of cellular ability of base excision repairポスター発表
- 第32回日本分子生物学会年会, 2009年12月, 日本語, 日本分子生物学会, パシフィコ横浜, 国内会議DNA damage recognition coordinated by the multiple xeroderma pigmentosum gene products口頭発表(一般)
- 第32回日本分子生物学会年会, 2009年12月, 日本語, 日本分子生物学会, パシフィコ横浜, 国内会議Centrin 2 mediates interaction between XPC and DDB2ポスター発表
- 2009 Japan-Taiwan Joint Symposium on Cell Signaling and Gene Regulation, 2009年11月, 日本語, Kobe University, National Cheng Kung University, 神戸, 国際会議Post-translational modifications involved in cellular DNA damage response口頭発表(一般)
- 第20回 DNA複製・組換え・修復ワークショップ, 2009年11月, 日本語, 3Rワークショップ2009事務局, 琵琶湖コンファレンスセンター, 国内会議Centrin 2 は損傷認識因子XPCとDDB2の相互作用を促進する口頭発表(一般)
- 国立遺伝学研究所研究集会「ユビキチン・SUMOによるDNA複製およびDNA修復系の制御」, 2009年10月, 日本語, 国立遺伝学研究所, 三島, 国内会議ヌクレオチド除去修復に関わるXPCの翻訳後修飾による機能制御口頭発表(一般)
- 日本遺伝学会第81回大会, 2009年09月, 日本語, 日本遺伝学会, 松本, 国内会議DNA損傷に伴うFANCD2(FA-D2)タンパク質のcaspase依存的切断口頭発表(一般)
- National Conference on Medical Genomics and Proteomics, 2009年09月, 英語, Novosibirsk, Russia, 国際会議Coordinated actions of multiple DNA damage detectors in nucleotide excision repair[招待有り]口頭発表(招待・特別)
- The 3rd ASM Conference on DNA Repair and Mutagenesis, 2009年06月, 英語, American Society for Microbiology, Whistler, BC, Canada, 国際会議Post-translational modification of XPC protein controls global genome nucleotide excision repairポスター発表
- International Symposium on DNA Damage Response and Repair Mechanisms, 2009年04月, 英語, The Integrated Project DNA Damage and Response Mechanisms, ギリシャ クレタ島, 国際会議Molecular basis for DNA damage recognition in nucleotide excision repair口頭発表(招待・特別)
- 第3回放射線防護研究センターシンポジウム, 2008年12月, 日本語, 放射線医学総合研究所, 千葉, 国内会議ヒトリンパ芽球細胞における放射線適応応答口頭発表(招待・特別)
- 第3回放射線防護研究センターシンポジウム, 2008年12月, 日本語, 放射線医学総合研究所, 千葉, 国内会議ヌクレオチド除去修復におけるゲノム損傷認識機構口頭発表(招待・特別)
- BMB2008 第31回日本分子生物学会年会・第81回日本生化学会大会, 2008年12月, 日本語, 日本分子生物学会・日本生化学会, 神戸, 国内会議ヌクレオチド除去修復におけるTFIHへリカーゼ活性調節機構の解析ポスター発表
- BMB2008 第31回日本分子生物学会年会・第81回日本生化学会大会, 2008年12月, 日本語, 日本分子生物学会・日本生化学会, 神戸, 国内会議ヌクレオチド除去修復におけるDNA損傷認識の分子機序口頭発表(一般)
- BMB2008 第31回日本分子生物学会年会・第81回日本生化学会大会, 2008年12月, 日本語, 日本分子生物学会・日本生化学会, 神戸, 国内会議Centrin 2 enhances in vitro nucleotide excision repair via complex formation with xeroderma pigmentosum group C pretein through its C-terminal domain.ポスター発表
- 日本放射線影響学会第51回大会, 2008年11月, 日本語, 日本放射線影響学会, 北九州, 国内会議DSB修復効率からの適応応答の追及口頭発表(一般)
- New Nuclear Research Symposium "Biological Response to Low Dose Radiation", 2008年11月, 英語, 新原子力基盤クロスオーバー研究「低線量域放射線に特有な生体反応の多面的解析」, 北九州, 国際会議Analysis of mutagenic radioadaptation in human lymphoblastoid cells口頭発表(招待・特別)
- 第67回日本癌学会学術総会, 2008年10月, 日本語, 日本癌学会, 名古屋, 国内会議Xeroderma pigmentosum proteins and their functions in DNA damage recognition口頭発表(一般)
- The 6th 3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2008年10月, 英語, 第6回3Rシンポジウム実行委員会, 掛川市, 国際会議Molecular mechanisms underlying efficient DNA damage recognition for nucleotide excision repair口頭発表(一般)
- The 6th3R Symposium (International Symposium on DNA Replication, Recombination and Repair), 2008年10月, 英語, 第6回3Rシンポジウム実行委員会, 掛川 つま恋リゾート, 国際会議Analyses of regulatory mechanisms of TFIIH helicase activity in nucleotide exicion repairポスター発表
- Russian-European Workshop on DNA Repair and Epigenetic Regulation of Genome Stability, 2008年06月, 英語, Institute of Chemical Biology and Fundermental Medicine, Russia St. Petersburg, 国際会議Damage recognition mechanism for mammalian nucleotide excision repair口頭発表(一般)
- 2007年度組換え・染色体再編ワークショップ・第19回DNA複製・分配ワークショップ・合同ワークショップ, 2008年03月, 日本語, 伊豆, 国内会議ヌクレオチド除去修復因子の細胞内動態とその制御機構口頭発表(一般)
- 第405回(総会)日本皮膚科学会大阪地方会, 2008年02月, 日本語, 大阪, 国内会議色素性乾皮症C群の小児例口頭発表(一般)
- シンポジウム「DNA修復研究の最前線」.第30回日本分子生物学会年会・第80回日本生化学会大会 (BMB2007), 2007年12月, 日本語, 日本分子生物学会・日本生化学会, 横浜, 国内会議ヌクレオチド除去修復因子の細胞内動態とその制御機構の解析ポスター発表
- ワークショップ「ユビキチン化を介したゲノムダイナミクスの制御」.第30回日本分子生物学会年会・第80回日本生化学会大会 (BMB2007), 2007年12月, 日本語, 日本分子生物学会・日本生化学会, 横浜, 国内会議ヌクレオチド除去修復における損傷認識とユビキチン化口頭発表(一般)
- 第30回日本分子生物学会年会・第80回日本生化学会大会 (BMB2007), 2007年12月, 日本語, 日本分子生物学会・日本生化学会, 横浜, 国内会議DNA修復因子と転写調節因子のSUMO化による活性調節の構造的基盤口頭発表(一般)
- 第5回SUMO研究集会, 2007年10月, 日本語, SUMO研究会, 京都, 国内会議ヌクレオチド除去修復におけるSUMO化の役割口頭発表(一般)
- 第66回日本癌学会学術総会, 2007年10月, 英語, 日本癌学会, 横浜, 国際会議Repair of UV-induced DNA damage: the molecular mechanism preventing skin cancer口頭発表(一般)
- 国立遺伝学研究所研究集会「ユビキチン・SUMOによるDNA複製およびDNA修復系の制御」, 2007年09月, 日本語, 三島, 国内会議ヌクレオチド除去修復に関わるユビキチン化とSUMO化[招待有り]口頭発表(招待・特別)
- バイオアーキテクトシンポジウム, 2007年09月, 日本語, 理化学研究所, 和光, 国内会議ゲノム損傷修復因子のin vivoダイナミクスとその制御機構口頭発表(一般)
- 3rd Japan-US DNA Repair Meeting, 2007年05月, 英語, Akira Yasui, Fumio Hanaoka, Kiyoji Tanaka, Errol Friedberg, Samuel Wilson, 秋保温泉 ホテルクレセント, 国際会議Molecular Mechanisms promoting repair of UV-induced DNA damage口頭発表(招待・特別)
- International Conference Cellular Responses to DNA Damage and Technical Workshop on DNA Repair, 2007年04月, 英語, Institute of Molecular Medicine, National Tsing-Hua University, 台湾, 国際会議Molecular mechanism of nucleotide excision repair as a defense against cancer口頭発表(招待・特別)
■ 共同研究・競争的資金等の研究課題
- 日本学術振興会, 科学研究費助成事業, 基盤研究(B), 神戸大学, 2021年04月01日 - 2025年03月31日環境ストレスによるゲノムDNA損傷の修復を保障するクロマチン作動原理の解明1.損傷部位にリクルートされるヒストン修飾酵素の解析: ヒストン脱アセチル化酵素HDAC1/2のDNA損傷部位へのリクルートが、転写コリプレッサー複合体のATPaseサブユニットに依存することを前年度までに見出した。このATPaseサブユニットの様々な欠失変異体を細胞で発現させたところ、転写コリプレッサー複合体の集合に関わるC末端領域は当該サブユニットの損傷部位へのリクルートに必須ではないことがわかった。以上のことから、ATPaseサブユニット自身が損傷部位の認識において本質的な役割を担うことが強く示唆された。 2.クロマチンとの相互作用を介したXPCの局在・動態制御機構の解析: ヒストン修飾を介したXPCタンパク質のクロマチン局在制御機構を理解するため、XPC中央部の天然変性領域(XPC-M)とヒストンH3テールの相互作用を、精製した組換えタンパク質を用いて詳細に解析した。ヒストンテールのリシン残基を様々な組み合わせでアセチル化ミミックであるグルタミンに置換したところ、特定のリシン残基のアセチル化ではなく、ヒストンテールの全体的な電荷状態がXPC-Mとの相互作用に重要である可能性が示唆された。 3.XPCのゲノムワイドな局在制御と損傷修復効率の相関: 前年度に引き続き、XPC及びヒストン修飾を標的とするクロマチン免疫沈降シーケンス(ChIP-seq)解析のためのサンプル調製及びデータ取得を行った。さらに、紫外線照射した細胞からヌクレオチド除去修復によって切り出された損傷オリゴヌクレオチドを回収し、次世代シーケンス解析に供するためのシステム構築を進めた。
- 日本学術振興会, 科学研究費助成事業 基盤研究(B), 基盤研究(B), 神戸大学, 2021年04月 - 2025年03月, 研究代表者環境ストレスによるゲノムDNA損傷の修復を保障するクロマチン作動原理の解明
- 科学研究費補助金/基盤研究(S), 2016年04月 - 2021年03月, 研究代表者競争的資金
- 科学研究費補助金/新学術領域研究, 2016年04月 - 2018年03月, 研究代表者競争的資金
- 国立研究開発法人日本医療研究開発機構,国立大学法人大阪大学, 創薬支援推進事業・創薬総合支援事業, 2017年色素性乾皮症治療薬の探索競争的資金
- 日本学術振興会, 科学研究費助成事業, 新学術領域研究(研究領域提案型), 筑波大学, 2011年04月01日 - 2016年03月31日生命素子による転写環境とエネルギー代謝のクロストーク本新学術領域研究は、転写環境の形成とエネルギー代謝シグナル間のクロストークを解明することを研究の目的とした。総括班では、領域班会議において、研究進捗状況の発表に加えて「Collaboration Proposal Meeting」を行い、研究者間の技術交流や共同研究を推進した。また、若手研究者や大学院生を主体としたワークショップや、全国で計58回にわたって行われた「転写代謝セミナー」の開催を支援した。さらにホームページでの情報発信に加え、市民公開講座の主催や、新聞、テレビなどのメディアを通して、研究成果を国民に広く公表した。
- 日本学術振興会, 科学研究費助成事業, 基盤研究(C), 2012年04月01日 - 2015年03月31日クロマチンDNAにおけるDNA修復機構の蛍光1分子イメージング真核生物(ヒト)のDNA修復において機能する修復タンパク質がDNAとどのように相互作用し、損傷部位を認識するのかを、これまで開発してきた1分子計測顕微鏡を用いて、1分子可視化した。その結果、DNA損傷認識に関わるXPC複合体(XPC-RAD23B)が損傷DNAに高いアフィニティで結合すること、DNA上で1次元拡散運動を行っていることを明らかにした。これら1次元拡散運動の拡散係数の値は広く分布しており、このことはXPC複合体が必ずしもDNAのらせんに忠実に沿って動かず、DNA上をより速く移動し、長大な非損傷DNAに存在する損傷を効率よく、かつ確実に見つけ出していることを示唆している。
- 日本学術振興会, 科学研究費助成事業, 基盤研究(B), 大阪大学, 2012年04月01日 - 2015年03月31日ジスルフィド結合の形成を利用したDNAの構造変化の検出と分子認識機構解明への応用DNAのらせん軸の折れ曲がりを化学的に検出するために各鎖の主溝を挟む位置に2-O-メルカプトアルキル-β-D-アラビノフラノースを含む2本鎖を合成し、シスプラチン付加体、塩基欠落部位アナログ、(6-4)光産物がDNAの構造に及ぼす影響を調べた結果、シスプラチン付加体に依存してジスルフィド結合が形成され、塩基欠落部位と(6-4)光産物においては動的に折れ曲がるという構造変化が示された。また、得られた折れ曲がりDNAを用いて、ヌクレオチド除去修復におけるUV-DDBタンパク質からXPCタンパク質への損傷DNAの受け渡し機構のモデルを証明した。
- 科学研究費補助金/基盤研究(A), 2012年04月 - 2015年03月, 研究代表者競争的資金
- 日本学術振興会, 科学研究費助成事業, 基盤研究(C), 熊本大学, 2011年 - 2013年SUMOとユビキチン複合鎖によるエピゲノム制御ユビキチンおよび類似タンパク質SUMOによる翻訳後修飾は核やクロマチン構造変換に関わることが知られているが、エピゲノム制御との関わりは不明な点が多い。チミンDNAグリコシラーゼ(TDG)は、シトシン(C)の修飾塩基5fCや5caCを認識し消去するDNAの脱メチル化反応に関わる塩基除去修復酵素である。本研究では、特に、細胞周期におけるTDGのSUMO化とユビキチン化と、SUMO修飾を認識してユビキチン化するE3リガーゼRNF4とSUMO化TDGの相互作用の解析に力を入れて解析を行った。その結果、エピゲノム情報の書き換えにおけるSUMOとユビキチン修飾の役割の一端が明らかになった。
- 科学研究費補助金/新学術領域研究, 2011年, 研究代表者競争的資金
- 科学研究費補助金/新学術領域研究, 2011年, 研究代表者競争的資金
- 2010年, 研究代表者厚生科研「神経皮膚症候群に関する調査研究」競争的資金
- 2009年, 研究代表者厚生科研「神経皮膚症候群に関する調査研究」競争的資金
- 2009年, 研究代表者ヌクレオチド除去修復におけるDNA損傷認識初期過程の化学生物学的研究競争的資金
- 科学研究費補助金/特定領域研究, 2008年, 研究代表者競争的資金
- 2008年, 研究代表者厚生科研「神経皮膚症候群に関する研究」競争的資金
- 科学研究費補助金/基盤研究(A), 2008年, 研究代表者競争的資金
- 2008年, 研究代表者ヌクレオチド除去修復におけるDNA損傷認識初期過程の化学生物学的研究競争的資金
- 特別研究員奨励費, 2008年, 研究代表者競争的資金
- 2007年, 研究代表者戦略的:ゲノムの修復機構を基盤とした癌化・老化の制御競争的資金
- 科学研究費補助金/特定領域研究, 2007年, 研究代表者競争的資金
- 科学研究費補助金/基盤研究(B), 2007年, 研究代表者競争的資金
- 2007年厚生科研:神経皮膚症候群に関する研究競争的資金
- 2000年 - 2004年, 研究代表者DNA修復機構のネットワークと核構造競争的資金
- 2000年 - 2004年, 研究代表者ヌクレオチド除去修復による遺伝情報維持と細胞機能制御機構競争的資金
- 日本学術振興会, 科学研究費助成事業, 基盤研究(C), 理化学研究所, 2000年 - 2001年DNA修復と蛋白質分解系をつなぐRAD23ホモローグの機能に関する研究DNA損傷に伴って特異的に誘起されるXPC蛋白質の翻訳後修飾がユビキチン化である可能性を検討するため、XP-C群患者由来のXP4PASV細胞でFLAG-XPCとHA-ユビキチンを同時に過剰発現した。この細胞抽出液からFLAG-XPCを免疫沈降することにより、XPCが細胞内でユビキチン化されうることが確認された。また、XPCの種々の欠失変異体を用いて同様の実験を行うことにより、比較的ユビキチン化を受けやすい領域が見いだされた。さらにこのユビキチン化の細胞内での機能を探る目的で、FLAG-XPCを生理的なレベルで安定に発現する細胞株を樹立した。これに紫外線や4-NQOなどの薬剤を用いてDNA損傷を与えると、クロマチン構造に強く結合するXPCの割合が増加する一方、ユビキチン化XPCの大部分は比較的穏和な条件でクロマチンから離れることがわかった。また、XPCのユビキチン化はG1/S境界からM期の間で、細胞周期に依存せずに起こることが示された。 XPC蛋白質と相互作用する新規因子を探索する目的で、酵母2ハイブリッド法によるスクリーニングを行ったところ、ユビキチン様蛋白質SUMO-1、およびその結合酵素であるUbc9が得られた。そこでユビキチン化の場合と同様にFLAG-XPCとHA-SUMO-1を同時に過剰発現することにより、XPCがSUMO-1化も受ける可能性があることが示唆された。 遺伝子ターゲティングによりHR23A、HR23Bを二重に欠損したマウス胎仔線維芽細胞を用いて、種々の変異HR23Bを安定に発現する細胞株を作成した。その結果、HR23BのN末端のユビキチン様配列はXPCの安定化、および損傷の除去活性そのものには必須でないことが明らかになった。
- 日本学術振興会, 科学研究費助成事業, 特定領域研究(C), 理化学研究所, 2000年 - 2000年突然変異に対する防御機構としてのDNA損傷認識機構の解明哺乳類のゲノム全体で働くヌクレオチド除去修復(NER)副経路において、DNA損傷認識因子として機能するXPC-HR23B複合体のDNAに対する結合特異性の詳細な解析を行なった。特定のDNA損傷や構造を部位特異的に含むDNA断片を用いてゲルシフト法やフットプリント法を行なうことにより、数個の非対合塩基(いわゆるバブル構造)があれば特に損傷が存在しなくてもXPC-HR23Bがこれを認識して結合できることが示された。すなわち、XPC-HR23BはDNA損傷そのものではなく、損傷によって誘起されるDNA構造の歪みを認識して結合すると考えられる。一方、これらのDNA基質を用いて無細胞NER反応を行なったところ、NER機構によるオリゴヌクレオチドの切り出しにはXPC-HR23Bの結合のみでは不十分で、バブル構造中に実際に損傷塩基が存在することが必要であった。以上の結果から、NERにおける損傷認識は(1)XPC-HR23BによるDNAの構造異常の認識、および(2)それに続く損傷塩基の確認、という少なくとも2段階の機構で行われていることが示された。さらに、XPC-HR23Bと相互作用する因子を探索する目的で、XPC蛋白質をbaitとして酵母2ハイブリッド法によるスクリーニングを行ない、複数のポジティブクローンを得た。現在、これらの因子とXPC-HR23Bとの相互作用の意義について、解析を進めている。さらに、XPCや別の損傷結合因子として知られるDDB因子のサブユニットにFLAGタグを融合したものを過剰発現する細胞株の単離を進めており、これを用いて相互作用する因子の解析を今後行なう予定である。
- 日本学術振興会, 科学研究費助成事業, 特定領域研究(A), 理化学研究所, 1999年 - 1999年ヌクレオチド除去修復機構におけるユビキチン蛋白分解系の役割RAD23ホモローグと26SプロテアソームのサブユニットS5a蛋白質との相互作用の意義を探る目的で、無細胞蛋白質分解反応系を用いた解析を行った。その結果、ユビキチン-プロテアソームを介した蛋白分解反応に対して、RAD23ホモローグが阻害的に作用することを見いだした。これは、RAD23ホモローグがS5aと結合することによって、ユビキチン化された分解基質蛋白質のプロテアソームとの相互作用を拮抗的に阻害した結果であると考えられた。即ち、RAD23ホモローグはプロテアソームによる蛋白質分解反応に対して、新しいタイプの制御因子として機能する可能性を持つことが示唆された。一方、HR23A、およびHR23Bそれぞれのノックアウトマウスを交配して二重欠損マウスの作成を試みた。二重欠損マウスは個体レベルでは致死的であると考えられたが、8.5日胚より二重欠損線維芽細胞を単離することに成功した。この二重欠損細胞はXPC欠損細胞と同等の紫外線感受性、および不定期DNA合成活性を示したが、紫外線照射後のRNA合成の回復能は正常であったことから、XPC変異細胞と同様に転写と共役したヌクレオチド除去修復機構は正常で、ゲノム全体で働く副経路に特異的な欠損を持つことがわかった。さらに、この二重欠損細胞ではXPC蛋白質の発現量が著しく低下していたことから、RAD23ホモローグがXPC蛋白質の安定な発現に重要な役割を果たしていることが示された。以上の結果から、RAD23ホモローグはゲノム全体で機能するヌクレオチド除去修復機構に必須であると同時に、おそらく蛋白質分解系の制御を介して個体の発生、分化、成長においても重要な機能を果たしていることが強く示唆された。
- 日本学術振興会, 科学研究費助成事業, 奨励研究(A), 理化学研究所, 1998年 - 1999年C群色素性乾皮症(XPC)蛋白質の構造と機能前年度までの組換え蛋白質を用いた無細胞系での実験から、C末端の125個のアミノ酸を欠失した変異XPC蛋白質は基本転写因子TFIIHとの相互作用に欠損が見られ、また無細胞ヌクレオチド除去修復反応においても不活性であることが明らかになった。そこで、この変異XPC蛋白質の細胞内での機能を解析する目的で、XP-C群細胞に変異遺伝子を導入して形質転換細胞株を樹立した。間接蛍光抗体染色により、上記のC末端欠失体、およびN末端の117個のアミノ酸を欠いた変異XPCはいずれも正常に核に移行できることを確認した。しかしながら、N末端欠失XPCを発現する細胞で紫外線抵抗性の回復が見られたのと対照的に、C末端欠失XPCを発現する細胞は親株のXPC欠損細胞と同等の紫外線感受性を示した。すなわち、無細胞系の結果と一致して、C末端部分はXPC蛋白質のヌクレオチド除去修復活性の発揮に必須であることが明らかになった。現在、C末端部分についてさらに細かい欠失変異体を作成しており、今後その構造機能相関を解析していく予定である。また、種々の変異XPC蛋白質を一過性に過剰発現して間接蛍光抗体染色を行なうことにより、XPC蛋白質の核移行に関わる配列をN末端付近に2ケ所同定した。 XPC蛋白質の活性が翻訳後修飾によって制御されている可能性を調べるため、まずXP-C群細胞にHA、またはFLAGタグを付加したXPC蛋白質のcDNAを導入して形質転換細胞株を単離した。これらの細胞株が正常細胞と同レベルのXPC蛋白質を発現していること、また紫外線抵抗性の回復からタグをつけたXPCが正常な機能を発揮できることを確認した。さらに、FLAGタグが特異的な免疫沈降に非常に有効であることを確かめたので、今後紫外線照射前後でのリン酸化の変動等を解析していく予定である。
- 日本学術振興会, 科学研究費助成事業, 特定領域研究(A), 理化学研究所, 1998年 - 1998年ヌクレオチド除去修復機構におけるユビキチン蛋白分解系の役割出芽酵母RAD23のヒト・ホモローグであるhHR23B蛋白質は、ヌクレオチド除去修復(NER)においてDNA損傷の認識に関わるXPC蛋白質と強固な複合体を形成する。我々は、酵母two-hybrid screeningにより、26Sプロテアソーム・サブユニットの一つ、S5aが.hHR23B、およびもう一つRAD23ホモローグであるhHR23Aと相互作用することを見出している。組換え蛋白質の欠失変異体を用いたbinding assayにより、hHR23BではN末端のユビキチン相同配列、S5aの側ではマルチュビキチン鎖結合部位として同定されたC末端に近い領域が、この相互作用に必要であることがわかった。さらに、細胞抽出液を用いたグリセロール密度勾配遠心、およびプロテアソーム・サブユニットに対する抗体を用いた免疫共沈降実験から、細胞内においてもhHR23Bの少なくとも一部はプロテアソームに結合していることが示唆された。一方、二つのRAD23ホモローグのそれぞれについて、ノックアウトマウスを作成レた。mHR23A欠損マウスは外見上まったく正常であったが、mHR23B欠損マウスはメンデル則からの期待値の1/10程度の頻度でしか得られず、また個体サイズも野生型と比較して明らかに小さい。しかしながら、このマウスから単離したmHR23B欠損細胞のNER能は野生型と同様であった。このことは、NERに関しては二つのRAD23ホモローグ間に機能的互換性があること、また823Bは個体の発生、成長過程において、NER獣外の何らかの重要な機能を果たしていることを示している。
- 日本学術振興会, 科学研究費助成事業, 重点領域研究, 1995年 - 1995年DNA複製、修復系を標的とした治療法の開発研究代表者と研究分担者は、DNA複製系及び修復系をターゲットとした新規抗がん剤の開発を目指して、以下に述べる研究を行なった。(1)前年度に引き続いて、既に確立されているSV40DNAの無細胞複製系、及び紫外線照射したSV40ミニ染色体を鋳型とする無細胞DNA修復系を用いて、100種ほどの放線菌培養上清から新たなDNA複製、及び修復阻害剤のスクリーニングを行なった。その結果、有意な阻害効果を示すサンプルを複数個、得ることが出来た。その中でDNA修復に阻害を示す4サンプルについて、DNAの損傷部位の上流および下流側に一本鎖切断を入れる反応を調べたところ、いずれもこの切断反応を阻害し、これらのサンプルがヌクレオチド除去修復反応の初期段階を阻害する活性を有していることが判明した。このステップの阻害剤は、これまで全く報告がなく、新規阻害剤の分離が期待される。(2)前年度までにDNA複製を強く阻害するものとして精製を行なっていたRK606については、構造決定の結果、大豆サポニンの一種、soyasaponin IIであることが判明した。類縁化合物のDNA複製阻害活性を比較したところ、アグリコン部分の他に、糖鎖の部分の構造も重要であること、また糖が3つ、分岐しない形で存在していると阻害活性が高いことが示された。DNA複製を阻害する化合物と、ワクシニアウイルスのdual-specific phosphatase,VH1フォスファターゼのヒトホモローグであるVHRフォスファターゼの阻害を示す化合物とが類似のスペクトルを示すことから、RK606の標的分子がフォスファターゼである可能性が示唆された。
- 日本学術振興会, 科学研究費助成事業, 奨励研究(A), 理化学研究所, 1994年 - 1994年無細胞系を用いたp53による染色体複製制御機構の研究バキュロウイルス・ベクター系を利用して昆虫細胞中で大量発現させたヒト野生型p53蛋白質をモノクローナルカラム抗体を用いて精製し、HeLa細胞の粗抽出液を用いたSV40DNAの無細胞複製系に添加して複製阻害を起こすことを確認した。この際、複製産物の解析から、p53蛋白質による複製阻害の作用点が主に複製開始段階にあることが示唆された。同様に4種類の変異型p53蛋白質(156Pro、248Trp、273His、285Lys)を昆虫細胞内で発現、精製したが、いずれも複製阻害活性を示さなかった。以上の結果は、精製蛋白質を用いた再構成複製系においても基本的に変わらなかった。モノクローナル抗体を用いた共沈降実験により、野生型p53蛋白質はSV40T抗原と試験管内で複合体を形成することが確かめられたが、4種類の変異型p53蛋白質は無細胞複製系の条件下では、いずれもSV40T抗原に結合しなかった。さらに、野生型p53蛋白質はSV40抗原の複製開始点への結合を阻害し、その結果としてT抗原による複製開始点を含む二重鎖DNA断片の一本鎖への巻き戻しを阻害するが、T抗原によって一本鎖環状M13DNA上の短いオリゴヌクレオチドが遊離される反応に対しては非常に弱い阻害効果しか示さないことがわかった。また、野生型p53蛋白質がSV40の複製開始点近傍に塩基配列特異的に結合することが報告されているが、この部分のDNA配列を欠失してもp53蛋白質による複製阻害が見られたことから、p53蛋白質の複製開始点近傍への結合は複製阻害にあまり重要でないと考えられた。以上の結果から、p53蛋白質によるSV40DNA複製阻害の機構は、主にSV40抗原との複合体形成によりT抗原の複製開始点への結合を阻害することにあると考えられる。
- 日本学術振興会, 科学研究費助成事業, 奨励研究(A), 理化学研究所, 1993年 - 1993年細胞同期における染色体複製の制御機構に関する研究SV40DNAの無細胞複製系に対する種々のプロテインキナーゼの影響を調べる目的で、まず精製された複製蛋白質に対して試験管内でリン酸化反応を行なってみた。その結果、MAPキナーゼやカゼインキナーゼIIがいくつかの複製蛋白質をリン酸化することが明らかとなった。しかしながら、これらのリン酸化反応によって各複製蛋白質の活性、および全体の複製反応に影響が見られるという結果は得られなかった。一方、ガン抑制遺伝子産物がG1期からS期への移行、染色体複製の開始を制御するという観点から、ヒトp53蛋白質の昆虫細胞における大量発現、ならびにモノクローナル抗体を用いた精製系を確立した。この系を用いて野生型ヒトp53蛋白質、およびヒトがん細胞から単離された数種の変異型p53蛋白質を精製し、SV40DNAの無細胞複製系に対する影響を解析した。その結果、野生型p53蛋白質SV40DNA複製を強く阻害したのに対して、変異型p53蛋白質はいずれも阻害を示さなかった。このSV40DNA複製の阻害活性と、それぞれのp53蛋白質のSV40T抗原との結合能の間には良い相関が見られ、実際に複製産物の解析から野生型p53による複製の阻害が開始段階の阻害であることが示唆された。現在、この組換えp53蛋白質を試験管内でリン酸化、および脱リン酸化した時に複製阻害活性に影響があるかどうか検討中である。
- 日本学術振興会, 科学研究費助成事業, 重点領域研究, 理化学研究所, 1993年 - 1993年哺乳類細胞のDNA修復機構と細胞周期制御の連関細胞周期におけるヌクレオチド除去修復活性の変動を解析する目的で、マウスFM3A細胞をnocodazoleでM期に同調後、解除して適当な時間培養したものをエルトリエーターで分画し、G1期の細胞を集めた。また、同様にFM3A細胞をaphidicolinでG1/S期境界に同調、及び解除することにより、エルトリエーター分画でS期とG2/M期の細胞を得た。これらの細胞より粗抽出液を調整し、無細胞修復系における活性を比較したところ、G2/M期の細胞抽出液がG1、及びS期の抽出液よりも2倍程度高い修復活性を示すことがわかった。さらに、マウスのcdc2キナーゼに変異を有するFM3A細胞の温度感受性突然変異株、tsFT210細胞を非許容温度でG2期に停止させたもの、及びこれをnocodazole存在下に許容温度に戻してM期に進めたものについて同様に修復活性を調べた。その結果、M期の細胞抽出液の方がG2期に停止した細胞抽出液よりも若干修復活性が高いという結果が得られた。現在、除去修復反応におけるcdc2キナーゼの関与、及び無細胞修復反応に伴う抽出液中のcdc2キナーゼの活性変動について検討中である。一方、哺乳類細胞のヌクレオチド除去修復自体に関与する因子を明らかにする目的で、C群色素性乾皮症の修復欠損を無細胞系で相補する蛋白質因子を同定し、その解析を進めているが、本年度においてはこの因子を構成する二種類のポリペプチドについてcDNAクローニングを行なった。
- 日本学術振興会, 科学研究費助成事業, 一般研究(B), 理化学研究所, 1992年 - 1993年哺乳類細胞DNA複製酵素の構造と機能に関する研究マウスFM3A細胞から分離した、DNAポリメラーゼαの温度感受性変異株、tsFT20、の180KサブユニットのcDNAを分離し、全塩基配列を決定した。その結果、1180番目のアミノ酸がセリンからフェニルアラニンに変化するような点突然変異を見出した。この変異株に、野生型180KサブユニットのcDNAを導入し、発現させたところ、温度感受性が相補された。従って、この変異がts性を引き起こしていると結論した。更に複数の増殖復帰株についても解析したところ、そのいずれもが、tsFT20細胞の突然変異点はそのままで、その近傍に第2の変異点を持っていた。 我々が既にクローニングし、全塩基配列を決定しているマウスDNAポリメラーゼα/プライマーゼを構成する4つのサブユニットのcDNAをプローブとして、4つのサブユニット遺伝子の細胞周期における発現様式をノーザンブロット法により調べた、その結果、GO期では、この4つの遺伝子はほとんど発現しておらず、血清刺激によるDNA合成に先立って、協調的に発現が誘導された。次に、これら4遺伝子の発現調節の機構を調べるために、それぞれの遺伝子上流域をクローニングし、塩基配列を決定した。4遺伝子とも転写開始点から300bp以内の領域に、1〜2個のE2F結合配列および10〜14bpからなるパリンドローム配列と1個のAP1配列が存在した。 一方、蛋白質レベルでの解析を行うため、各cDNAを大腸菌あるいは昆虫細胞で過剰発現させ、精製した各サブユニットを抗原として、ポリクローナル抗体を作成した。共沈降反応等により、各サブユニット間の相互作用を調べたところ、54Kサブユニットが他のサブユニットすべてに親和性を持つことを見い出した。更に発現・単離した180KサブユニットにはDNAポリメラーゼα活性が、46Kサブユニットにはプライマーゼ活性が、それぞれ検出された。
- 日本学術振興会, 科学研究費助成事業, 一般研究(B), 理化学研究所, 1990年 - 1991年DNAの複製及び修復の制御機構におけるクロマチン構造の関与まず我々が既に確立している、HeLa細胞粗抽出液を用いたSV40ウイルスのミニ染色体無細胞複製系を発展させ、精製蛋白質による複製系を確立した。この系はヒストンとして、鋳型DNAに結合している親ヌクレオソ-ムしか含まれないことから、親鎖DNAに結合していたヒストンの、複製時における挙動を調べるのに好適であった。そのような実験の結果、(1)親鎖DNAに結合していたヒストンは、複製時にもDNAからほとんど遊離しないこと、(2)それらのヒストンは、リ-ディング鎖とラギング鎖にほぼランダムに分布すること、(3)裸のDNAを鋳型にする場合と比較し、DNAトポイソメラ-ゼIIの要求性が異なり、SV40ミニ染色体の複製においては、topoIIは、いわゆるswivelaseとして機能すること、などが判明した。 一方、SV40ミニ染色体に紫外線照射したものを鋳型にして、無細胞染色体修復系の構築を試みた。放射標識した基質とATPの存在下、鋳型なHeLa細胞の粗抽出液と反応させ、DNAを抽出後、アガロ-スゲル電気泳動にかけ、オ-トラジオグラフィ-によって修復合成を検出した。反応液中に紫外線照射しない裸のプラスミドDNAを適当量共存させることにより、紫外線照射したSV40染色体としなかったものとで10倍以上の放射能取り込みの差が得られた。この紫外線損傷依存性のDNA合成は、色素性乾皮症の相補性群AおよびCに属する細胞の抽出液を用いた場合には、HeLa細胞抽出液を用いた場合のそれぞれ1/10および1/3程度であり、両者を混合することにより取り込みが回復した。今後、この無細胞系は、クロマチンのDNA損傷の修復機構解析に有用であろう。
研究シーズ
■ 研究シーズ- 紫外線によるDNA損傷を修復し皮膚がんを防ぐメカニズムの解明シーズカテゴリ:ライフサイエンス, 環境・農学, 自然科学一般研究キーワード:DNA損傷修復, 色素性乾皮症, 皮膚がん, 紫外線, クロマチン研究の背景と目的:太陽光に含まれる紫外線が皮膚にあたると、細胞が持つゲノムDNAに損傷が発生します。このようなDNA損傷を放置すると、突然変異や染色体異常、細胞死などを引き起こし、やがて皮膚がんなどの疾患の発症につながります。DNA損傷を見つけて元通りに修復するメカニズムは生体防御機構として非常に重要であり、その詳細な理解を通してがんをはじめとする様々な疾患の予防に資することを目的として研究を進めています。研究内容:ヒト細胞において紫外線によるDNA損傷は、ヌクレオチド除去修復(NER)と呼ばれるメカニズムによって修復されます。DNA修復では、あるタンパク質が損傷を見つけて結合する「損傷認識」という最初のステップが反応全体の効率を左右する鍵を握っており、ヒト細胞のNERでは色素性乾皮症の原因遺伝子産物の一つであるXPCタンパク質がこの過程で最も重要な役割を担っています。私たちは、細胞内でXPCによる効率的なDNA損傷認識を保障するメカニズムの研究を進め、タンパク質分解に関わるユビキチン-プロテアソーム系の新たな役割を明らかにしました。また、染色体を構成するヒストンタンパク質の翻訳後修飾の変化、特にDNA損傷部位におけるヒストンの脱アセチル化がXPCを積極的に呼び込み、損傷認識効率の上昇に寄与していることを示しました。他のヒストン修飾やクロマチン構造変換因子の機能を含め、さらに詳細な解析を進めています。
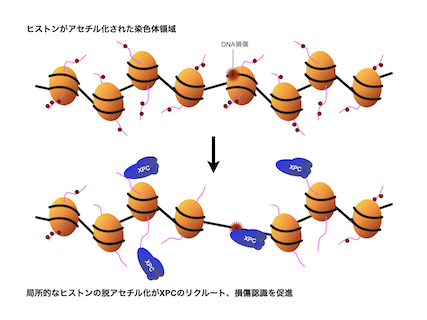 期待される効果や応用分野:紫外線によるDNA損傷の認識・修復を助ける詳しいメカニズムを理解することで、私たちが生来持つDNA修復の機能を強化し、皮膚がんの予防や紫外線に対する新たな防護法の開発につながる可能性があります。NERは紫外線だけでなく、化学発がん物質によるDNA損傷の修復も担っており、本研究の成果は医学、薬学、農学、環境学などの幅広い分野での応用研究につながる可能性があります。関係する業績:1) Sakai, W., et al. Sci. Rep. 10: 19704 (2020). 2) Matsumoto, S., et al. Nature 571: 79-84 (2019). 3) Kakumu, E., et al. Genes Cells 22: 310-327 (2017).
期待される効果や応用分野:紫外線によるDNA損傷の認識・修復を助ける詳しいメカニズムを理解することで、私たちが生来持つDNA修復の機能を強化し、皮膚がんの予防や紫外線に対する新たな防護法の開発につながる可能性があります。NERは紫外線だけでなく、化学発がん物質によるDNA損傷の修復も担っており、本研究の成果は医学、薬学、農学、環境学などの幅広い分野での応用研究につながる可能性があります。関係する業績:1) Sakai, W., et al. Sci. Rep. 10: 19704 (2020). 2) Matsumoto, S., et al. Nature 571: 79-84 (2019). 3) Kakumu, E., et al. Genes Cells 22: 310-327 (2017).
 garnet.kobe-u.ac.jp
garnet.kobe-u.ac.jp